题目内容
5.下列反应过程中的能量变化与如图相符的是( )
| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
分析 根据图象可知,反应物总能量小于生成物总能量,该反应为吸热反应,
①放热反应:有热量放出的化学反应,因为反应物具有的总能量高于生成物具有的总能量.常见放热反应:燃烧与缓慢氧化,中和反应;金属与酸反应制取氢气,生石灰和水反应等.
②吸热反应:有热量吸收的化学反应,因为反应物具有的总能量低于生成物具有的总能量.常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO及KClO3、KMnO4、CaCO3的分解等.
解答 解:A.钠与水的反应为放热反应,故A错误;
B.生石灰为氧化钙,氧化钙和水反应是放热反应,故B错误;
C.铝热反应为放热反应,故C错误;
D.碳酸钙高温分解的反应为吸热反应,故D正确;
故选D.
点评 本题考查反应热与焓变的应用,题目难度不大,明确化学反应与能量变化的关系为解答关键,注意掌握常见吸热反应、放热反应类型,试题培养了学生的灵活应用能力.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
11.在恒容密闭容器中发生反应H2(g)+I2(g)?2HI(g)+9.4kJ,下列说法能说明该反应一定达到平衡的是( )
| A. | 混合气体的密度不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量恰好为9.4kJ时 | D. | 混合气体的压强不再发生变化 |
16.用如图所示装置进行以下实验,能达到实验目的是( )
| X | Y | Z | 目的 | 装置 | |
| A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 | 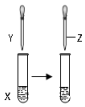 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
| C | 1mol/LNaOH 溶液5mL | 1-氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1-氯丁烷中含有氯元素 | |
| D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
13.短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同.下列说法正确的是( )
| A. | X的氢化物中仅含有极性键 | |
| B. | X与Y形成的三原子分子的电子式是 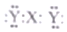 | |
| C. | 原子半径Z>Y,离子半径Z2+<Y2- | |
| D. | X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断 |
20.配制一定物质的量浓度的Na2CO3溶液时,下下列因素会导致溶液浓度偏高的是( )
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
10.对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )
| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
17.下列变化中,不需要破坏化学键的是( )
| A. | HCl溶于水 | B. | 食盐熔融 | C. | 碘单质溶于苯 | D. | 石油裂化 |
14.液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷沸点高 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
15.下列对分子及其性质的解释中,不正确的是( )
| A. | 液态氟化氢分子间存在氢键,所以氟化氢的沸点比氯化氢高 | |
| B. | CH4、CO2、C2H2都是含有极性键的非极性分子 | |
| C. | [Cu(NH3)4]2+中含有离子键、极性键、配位键 | |
| D. | 因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO4 |