题目内容
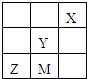 四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )
四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )| A、Z的氢化物中中心原子的杂化方式为sp3 |
| B、Z原子的第一电离能小于M原子的第一电离能 |
| C、四种元素全部位于p区 |
| D、M、Y、Z最高价氧化物对应水化物的酸性从强到弱的顺序为:Y>M>Z |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由四种非金属主族元素M、X、Y、Z在周期表中相对位置,可知X为F元素、Y为S元素、M为Se元素、Z为As元素.
A.Z的氢化物为AsH3,计算As原子价层电子对数,确定杂化方式;
B.As元素原子4p轨道容纳3个电子,为半满稳定状态,能量较低;
C.p区元素包含ⅢA族~ⅦA族及零族元素;
D.非金属性越强,最高价含氧酸的酸性越强.
A.Z的氢化物为AsH3,计算As原子价层电子对数,确定杂化方式;
B.As元素原子4p轨道容纳3个电子,为半满稳定状态,能量较低;
C.p区元素包含ⅢA族~ⅦA族及零族元素;
D.非金属性越强,最高价含氧酸的酸性越强.
解答:
解:由四种非金属主族元素M、X、Y、Z在周期表中相对位置,可知X为F元素、Y为S元素、M为Se元素、Z为As元素.
A.Z的氢化物为AsH3,s原子价层电子对数=3+
=4,采取sp3杂化方式,故A正确;
B.As元素原子4p轨道容纳3个电子,为半满稳定状态,能量较低,其第一电离能故同周期相邻元素,故B错误;
C.p区元素包含ⅢA族~ⅦA族及零族元素,F、S、Se、As均属于p区元素,故C正确;
D.非金属性Y>M>Z,非金属性越强,最高价含氧酸的酸性越强,故酸性:Y>M>Z,故D正确,
故选B.
A.Z的氢化物为AsH3,s原子价层电子对数=3+
| 5×3 |
| 2 |
B.As元素原子4p轨道容纳3个电子,为半满稳定状态,能量较低,其第一电离能故同周期相邻元素,故B错误;
C.p区元素包含ⅢA族~ⅦA族及零族元素,F、S、Se、As均属于p区元素,故C正确;
D.非金属性Y>M>Z,非金属性越强,最高价含氧酸的酸性越强,故酸性:Y>M>Z,故D正确,
故选B.
点评:本题考查元素周期表与元素周期律、杂化轨道等,需要学生熟练掌握元素周期表的结构,注意理解同周期元素第一电离能异常原因.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、78 g Na2O2与足量水反应中电子转移了0.2NA |
| B、1 mol甲基中含有7 NA 个电子 |
| C、62 g白磷中含P-P键为3 NA |
| D、1 mol氖气含有的原子数为2 NA |
向下列液体中投入金属钠,没有气体产生的是( )
| A、H2O |
| B、C6H6 |
| C、CH3CH2OH |
| D、CH3COOH |
在40GPa高压下,用激光器加热到1 800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是( )
| A、原子晶体干冰易汽化,可用作制冷剂 |
| B、原子晶体干冰有很高的熔点和沸点 |
| C、原子晶体干冰的硬度小,不能用作耐磨材料 |
| D、1 mol原子晶体干冰中含2 mol C-O键 |
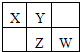 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )| A、四种元素的氢化物中,Y的氢化物沸点最高 |
| B、Z的单质不溶于水,有多种同素异形体 |
| C、阴离子的还原性:X<Y |
| D、X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 |
将3mol 甲烷与氯气发生取代反应,待反应完全后测知四种取代物的物质的量相同,测消耗的氯气有( )
| A、2mol | B、10mol |
| C、7.5mol | D、6mol |