题目内容
1.纳米级MnO2有很高的活性,以二氧化锰为电极构成的甲醇燃料电池如图所示,下列说法不正确的是( )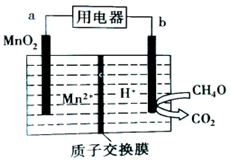
| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应为CH4O-6e-+H2O=CO2+6H+ | |
| C. | 电子从b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧移向右侧 |
分析 正极上二氧化锰得电子生成锰离子,负极上CH4O失电子生成二氧化碳,原电池中电子从负极向正极移动,溶液中阳离子向正极移动,据此分析.
解答 解:A.原电池中正极上发生得电子的氧化反应,所以a极为正极,正极上二氧化锰得电子生成锰离子,发生还原反应,故A正确;
B.b为负极,负极上CH4O失电子生成二氧化碳,则电极反应式为CH4O-6e-+H2O=CO2↑+6H+,故B正确;
C.原电池中电子从负极向正极移动,即电子由b极流出经用电器流向a极,故C正确;
D.溶液中阳离子向正极移动,则放电时H+由质子交换膜右侧向左侧迁移,故D错误.
故选D.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
16.下列有机反应中,不属于取代反应的是( )
| A. | 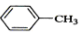 +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$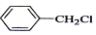 +HCl +HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | ClCH2CH=CH2+NaOH→HOCH2CH=CH2+NaCl | |
| D. | 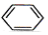 +HONO2$\stackrel{浓硫酸}{→}$ +HONO2$\stackrel{浓硫酸}{→}$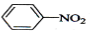 +H2O +H2O |
6.下列物质中不能使溴水因发生化学反应而褪色,但能使酸性KMnO4溶液褪色的是( )
| A. | 乙烯 | B. | 苯 | C. | 乙苯 | D. | 乙烷 |
13.某盐的混合物溶液中含有Na+、Mg2+、Cl-、SO42-4种离子,其3种浓度分别为0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Cl-,则SO42-为( )
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
10.下列离子方程式正确的是( )
| A. | 向含2molFeBr2的溶液中通入1molCl2:2Fe2++Cl2═2Cl-+2Fe3+ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
11.铊(Tl)盐与氰化钾(KCN)被列为A级危险品.已知下列反应在一定条件下能够发生:①TI3++2Ag=Tl++2Ag+,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是( )
| A. | TI3+>Fe3+>Ag+ | B. | Fe3+>Ag+>TI3+ | C. | Tl+>Ag+>Fe2+ | D. | TI3+>Ag+>Fe2+ |