题目内容
13.某盐的混合物溶液中含有Na+、Mg2+、Cl-、SO42-4种离子,其3种浓度分别为0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Cl-,则SO42-为( )| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
分析 混合液呈电中性,根据电荷守恒,溶液中一定满足:c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),据此进行计算.
解答 解:溶液呈电中性,根据电荷守恒可知:c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
即:0.2mol/L+2×0.4mol/L=0.4mol/L+2c(SO42-),
解得:c(SO42-)=0.3mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确电荷守恒为解答关键,注意熟练掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.向含有1mol KAl(SO4)2的溶液中逐滴加入Ba(OH)2溶液,充分反应,下列说法正确的是( )
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)22 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
4.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
| A. | FeCl3溶液(FeCl2):通入适量Cl2 | |
| B. | Fe2O3固体(Al2O3):加入烧碱溶液,过滤 | |
| C. | Cl2气体(HCl):通过NaOH溶液洗气后干燥 | |
| D. | Na2CO3固体(NaHCO3):加热 |
1.纳米级MnO2有很高的活性,以二氧化锰为电极构成的甲醇燃料电池如图所示,下列说法不正确的是( )
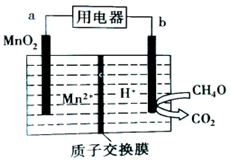

| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应为CH4O-6e-+H2O=CO2+6H+ | |
| C. | 电子从b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧移向右侧 |
18.用pH试纸测量碱溶液的pH时,若事先将pH试纸用蒸馏水润湿,则测量结果会( )
| A. | 偏大 | B. | 偏小 | C. | 不变 | D. | 无法判断 |
2.下列各反应的离子方程式中,错误的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 氯化镁溶液中加入氢氧化钠溶液:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铝片放入过量浓NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将铜片放入过量稀HNO3溶液中:3Cu+8HNO3═3Cu2++6NO3-+2NO↑+4H2O |
3.有关下列反应前后变化说法正确的是( )
| A. | 钠粒投入100mL稀盐酸中,溶液质量减轻 | |
| B. | 加热氧化钠和过氧化钠固体混合物,固体质量减轻 | |
| C. | 铁钉放入氯化铜溶液中,固体质量增大 | |
| D. | 光照新制氯水,溶液的颜色变浅,酸性减弱 |