题目内容
9.高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-.用该电池电解100mL 1mol•L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为1(溶液体积变化忽略不计).分析 高铁酸钾在正极得到电子发生还原反应,据此书写电极反应式;该电池电解100mL 1mol•L-1的AgNO3溶液,根据阳极的电极反应来计算pH.
解答 解:高铁酸钾在正极得到电子,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,该电池电解100mL 1mol•L-1的AgNO3溶液,阳极的电极反应:
4OH--4e-=2H2O+O2↑
0.01mol 0.01mol
所以产生的H+的物质的量为0.01mol,其物质的量浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L,所以pH=1,
故答案为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-,1.
点评 本题考查了学生运用原电池、电解等基础理论解决新情景问题的能力,本题难度不大,注意掌握电极反应式的书写及电子转移数目的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列各组离子一定能大量共存的是( )
| A. | 澄清透明的无色溶液:MnO4-、Na+、I-、Mg2+ | |
| B. | 含有0.1mol/L Fe3+的溶液中:Na+、Ca2+、SCN-、SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32-、SO42-、Na+、NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+、Cl-、NO3-、Ba2+ |
17.已知2SO2(g)+O2 (g)?2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
| A. | 容器内压强p p甲=p丙>2p乙 | |
| B. | SO3的质量m m甲=m丙<2m乙 | |
| C. | c(SO2)与c(O2)之比k k甲=k丙>2k乙 | |
| D. | 反应放出或吸收热量的数值Q Q甲=197-Q丙>2Q乙 |
4.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
| A. | FeCl3溶液(FeCl2):通入适量Cl2 | |
| B. | Fe2O3固体(Al2O3):加入烧碱溶液,过滤 | |
| C. | Cl2气体(HCl):通过NaOH溶液洗气后干燥 | |
| D. | Na2CO3固体(NaHCO3):加热 |
14.下列离子方程式正确的是( )
| A. | 氯气和水发生反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用NaOH溶液除去铝表面的氧化膜时产生气泡:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ | |
| C. | 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 将铁粉加入稀硫酸和硝酸钾混合溶液中,铁粉溶解:Fe+2H+=Fe2++H2↑ |
1.纳米级MnO2有很高的活性,以二氧化锰为电极构成的甲醇燃料电池如图所示,下列说法不正确的是( )
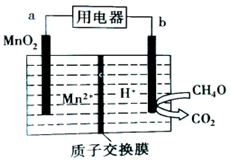

| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应为CH4O-6e-+H2O=CO2+6H+ | |
| C. | 电子从b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧移向右侧 |
18.用pH试纸测量碱溶液的pH时,若事先将pH试纸用蒸馏水润湿,则测量结果会( )
| A. | 偏大 | B. | 偏小 | C. | 不变 | D. | 无法判断 |
19.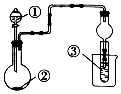 利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
 利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
利用如图装置进行下列实验,一定不能得出相关实验现象的是( )| 选项 | ① | ② | ③ | ④ |
| A | 醋酸水溶液 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓盐酸 | 浓硫酸 | 石蕊溶液 | 出现红色 |
| D | 浓盐酸 | Na2CO3 | CaCl2溶液 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |