题目内容
11.铊(Tl)盐与氰化钾(KCN)被列为A级危险品.已知下列反应在一定条件下能够发生:①TI3++2Ag=Tl++2Ag+,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是( )| A. | TI3+>Fe3+>Ag+ | B. | Fe3+>Ag+>TI3+ | C. | Tl+>Ag+>Fe2+ | D. | TI3+>Ag+>Fe2+ |
分析 自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断氧化性强弱.
解答 解:①反应Tl3++2Ag═Tl++2Ag+中,氧化剂是Tl3+,氧化产物是Ag+,所以氧化性Tl3+>Ag+,
②反应Ag++Fe2+═Ag+Fe3+中,氧化剂是Ag+,氧化产物是Fe3+,所以氧化性Ag+>Fe3+,
③Fe+2Fe3+═3Fe2+中,氧化剂是Fe3+,氧化产物是Fe2+,所以氧化性Fe3+>Fe2+,
所以氧化性强弱顺序是Tl3+>Ag+>Fe3+>Fe2+,
故选D.
点评 本题考查氧化性强弱的比较,明确氧化剂、氧化产物是解本题关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
1.纳米级MnO2有很高的活性,以二氧化锰为电极构成的甲醇燃料电池如图所示,下列说法不正确的是( )
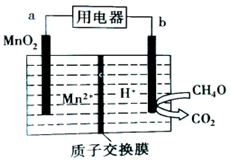

| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应为CH4O-6e-+H2O=CO2+6H+ | |
| C. | 电子从b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧移向右侧 |
2.下列各反应的离子方程式中,错误的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 氯化镁溶液中加入氢氧化钠溶液:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铝片放入过量浓NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将铜片放入过量稀HNO3溶液中:3Cu+8HNO3═3Cu2++6NO3-+2NO↑+4H2O |
19.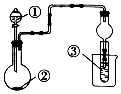 利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
 利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
利用如图装置进行下列实验,一定不能得出相关实验现象的是( )| 选项 | ① | ② | ③ | ④ |
| A | 醋酸水溶液 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓盐酸 | 浓硫酸 | 石蕊溶液 | 出现红色 |
| D | 浓盐酸 | Na2CO3 | CaCl2溶液 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
6.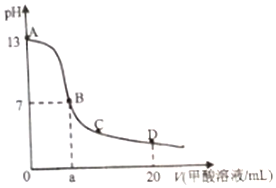 在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
 在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )| A. | 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 | |
| B. | 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+) | |
| C. | 在D点:c(HCOO-)+c(HCOOH)>2c(K+) | |
| D. | B→C段:水的电离程度先增大后减小 |
3.有关下列反应前后变化说法正确的是( )
| A. | 钠粒投入100mL稀盐酸中,溶液质量减轻 | |
| B. | 加热氧化钠和过氧化钠固体混合物,固体质量减轻 | |
| C. | 铁钉放入氯化铜溶液中,固体质量增大 | |
| D. | 光照新制氯水,溶液的颜色变浅,酸性减弱 |
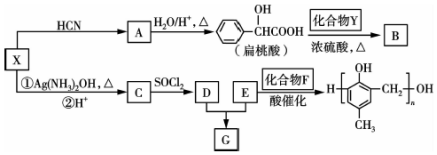
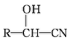 RCHO$→_{△}^{H_{2}O/H+}$
RCHO$→_{△}^{H_{2}O/H+}$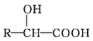
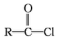 $\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基)
$\stackrel{R'OH}{→}$RCOOR'(R、R'代表烃基) .
.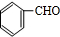 +2Ag(NH3)2OH$\stackrel{水浴△}{→}$
+2Ag(NH3)2OH$\stackrel{水浴△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +
+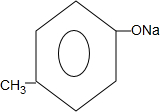 +H2O.
+H2O.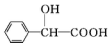 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式:
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式: .
.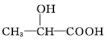 )的路线(其他无机试剂任选).合成路线流程图示例如下:
)的路线(其他无机试剂任选).合成路线流程图示例如下: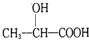 .
.