题目内容
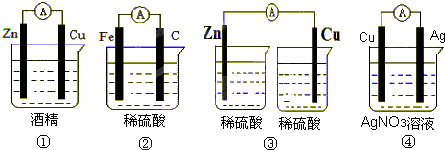
( I)下列装置能组成原电池的是
( II)如图④所示,若是原电池,请回答下列问题(若不是原电池,则不用回答).
(1)负极材料是
(2)正极的电极反应式为
(3)电池工作时总反应的离子方程式是
(4)导线中电子的流向
(5)阳离子的移动方向
(6)该装置将
考点:原电池和电解池的工作原理
专题:电化学专题
分析:( I):①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;
(II)该装置符合原电池构成条件,所以是原电池,是将化学能转化为电能的装置,Cu易失电子作负极、Ag作正极,负极反应式为Cu-2e-=Cu2+、正极反应式为Ag++e-=Ag,所以电池反应式为Cu+2Ag+=Cu2++2Ag,电子从负极沿导线流向正极,电解质溶液中阳离子向正极移动、阴离子向负极移动.
(II)该装置符合原电池构成条件,所以是原电池,是将化学能转化为电能的装置,Cu易失电子作负极、Ag作正极,负极反应式为Cu-2e-=Cu2+、正极反应式为Ag++e-=Ag,所以电池反应式为Cu+2Ag+=Cu2++2Ag,电子从负极沿导线流向正极,电解质溶液中阳离子向正极移动、阴离子向负极移动.
解答:
解:( I):①不能自发的进行氧化还原反应,所以不能构成原电池,故错误;
②该装置符合原电池构成条件,所以能构成原电池,Fe作负极、C作正极,故正确;
③该装置不能构成闭合回路,所以不能形成原电池,故错误;
④该装置符合原电池构成条件,所以能构成原电池,Cu作负极、Ag作正极,故正确;
故选;②④;
(II)(1)该装置中Cu活泼性大于Ag,所以Cu易失电子作负极、Ag作正极,故答案为:Cu;
(2)正极上银离子得电子发生还原反应,所以正极的电极反应式为Ag++e-=Ag,故答案为:Ag++e-=Ag;
(3)负极反应式为Cu-2e-=Cu2+、正极反应式为Ag++e-=Ag,所以电池反应式为Cu+2Ag+=Cu2++2Ag,故答案为:Cu+2Ag+=Cu2++2Ag;
(4)负极上失电子、正极上得电子,所以导线中电子的流向从负极Cu流向正极Ag,故答案为:负极Cu流向正极Ag;
(5)阳离子的移动方向正极,银离子移向负极,故答案为:移向正极;
(6)该在是原电池,是将化学能转化为电能的装置,故答案为:化学;电.
②该装置符合原电池构成条件,所以能构成原电池,Fe作负极、C作正极,故正确;
③该装置不能构成闭合回路,所以不能形成原电池,故错误;
④该装置符合原电池构成条件,所以能构成原电池,Cu作负极、Ag作正极,故正确;
故选;②④;
(II)(1)该装置中Cu活泼性大于Ag,所以Cu易失电子作负极、Ag作正极,故答案为:Cu;
(2)正极上银离子得电子发生还原反应,所以正极的电极反应式为Ag++e-=Ag,故答案为:Ag++e-=Ag;
(3)负极反应式为Cu-2e-=Cu2+、正极反应式为Ag++e-=Ag,所以电池反应式为Cu+2Ag+=Cu2++2Ag,故答案为:Cu+2Ag+=Cu2++2Ag;
(4)负极上失电子、正极上得电子,所以导线中电子的流向从负极Cu流向正极Ag,故答案为:负极Cu流向正极Ag;
(5)阳离子的移动方向正极,银离子移向负极,故答案为:移向正极;
(6)该在是原电池,是将化学能转化为电能的装置,故答案为:化学;电.
点评:本题考查了原电池原理,涉及原电池判断、正负极判断、电极反应式的书写、离子及电子流动方向等知识点,根据原电池构成条件、电极反应式书写方法等知识点分析解答即可,注意电解质溶液中离子移动方向的判断,为易错点.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
可逆反应2A(g)+3B(g)?2C(g)+D(g)在四种不同条件下有以下4种反应速率,则该反应在不同条件下反应速率最快的是( )
| A、v(A)=0.5mol/(L.s) |
| B、v(B)=0.6mol/(L.s) |
| C、v(C)=0.35mol/(L.s) |
| D、v(D)=0.4mol/(L.s) |
合理使用食品添加剂,可以使食物色、香、味俱全.下列食品添加剂中,属于发色剂的是( )
| A、番茄红素 | B、谷氨酸钠 |
| C、亚硝酸钠 | D、柠檬黄 |
化学式为C4H8的链状烃有(考虑顺反异构体)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
组成为C4H9Cl的卤代烃,可能存在的同分异构体有( )
| A、三种 | B、四种 | C、五种 | D、六种 |
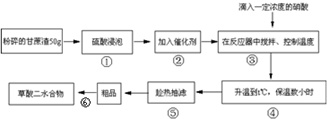
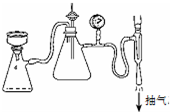 步骤⑥采用的操作方法是:
步骤⑥采用的操作方法是: