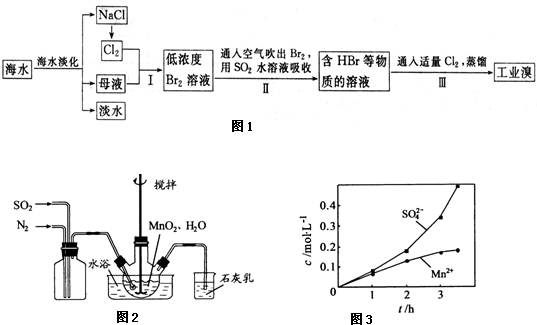
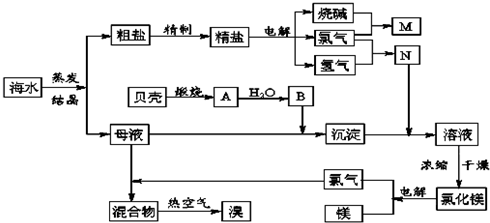
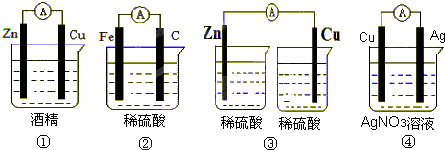
题目内容
NaOH的摩尔质量为 ,1.204×1023个NaOH分子物质的量为 ,中和这些OH-,需要 g HCl.
考点:物质的量的相关计算
专题:计算题
分析:M(NaOH)=40g/mol,n=
,发生NaOH+HCl=NaCl+H2O,结合反应的方程式计算.
| N |
| NA |
解答:
解:NaOH的相对分子质量为40,则摩尔质量为40g/mol,
n(NaOH)=
=0.2mol,
发生NaOH+HCl=NaCl+H2O,
则n(HCl)=n(NaOH)=0.2mol,
m(HCl)=0.2mol×36.5g/mol=7.3g,
故答案为:40g/mol;0.2mol;7.3.
n(NaOH)=
| 1.204×1023 |
| 6.02×1023/mol |
发生NaOH+HCl=NaCl+H2O,
则n(HCl)=n(NaOH)=0.2mol,
m(HCl)=0.2mol×36.5g/mol=7.3g,
故答案为:40g/mol;0.2mol;7.3.
点评:本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
不能用H++OH-═H2O表示的离子反应的是( )
| A、氢氧化钠溶液和硫酸氢钠溶液 |
| B、氢氧化钡和硫酸溶液 |
| C、硫酸氢铵溶液和少量氢氧化钠溶液 |
| D、石灰水和硝酸溶液 |
下列关于NaHCO3和Na2CO3的说法中,正确的是( )
| A、NaHCO3的热稳定性比Na2CO3的热稳定强 |
| B、可以用加热的方法除去Na2CO3溶液中混有的少量NaHCO3 |
| C、NaHCO3比Na2CO3容易溶于水 |
| D、NaHCO3既能与盐酸发生反应,又能与NaOH溶液发生反应 |