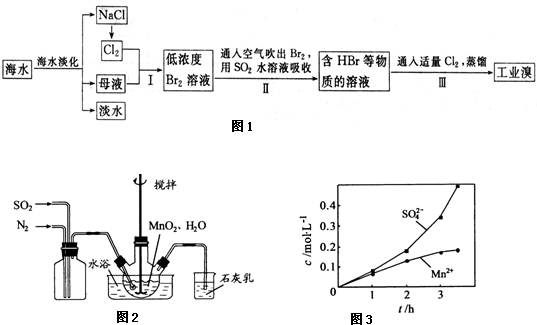
题目内容
草酸作为一种重要的化工原料,某学习小组的同学拟以甘蔗渣为原料用水解-氧化-水解技术制取草酸.
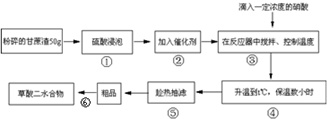
试回答下列问题
(1)第①步硫酸的主要作用是: ;由表1可确定,合适的硫酸质量分数是: (选择表中数据);由表2,合适的浸泡时间 小时.
表1 硫酸浓度对草酸收率的影响
表2甘蔗渣浸时间对草酸收率的影响
(2)步骤⑤是减压抽滤(如图),其优点是: ;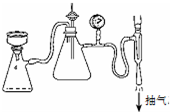 步骤⑥采用的操作方法是: .
步骤⑥采用的操作方法是: .
(3)为了确定产品中H2C2O4?2H2O的纯度,称取10.5g草酸样品,配成250mL溶液,每次实验时准确量取40.00mL草酸溶液,加入适量的稀硫酸,用0.1mol/LKMnO4标准溶液滴定.平行滴定三次,消耗KMnO4标准溶液平均为16.00mL,下列有关说法正确的是 .
A.KMnO4标准溶液盛放在碱式滴定管中
B.可从酸式滴定管中准确放出40.00mL草酸溶液
C.该实验不需要加指示剂
D.测得产品中的草酸晶体纯度约为95.0%

试回答下列问题
(1)第①步硫酸的主要作用是:
表1 硫酸浓度对草酸收率的影响
| 硫酸质量分数% | 草酸收率% | 甘蔗渣浸泡后现象 |
| 60 | 36.0 | 甘蔗呈糖浆状,大量为固体 |
| 65 | 60.3 | 大量呈糖浆状,少量为固体 |
| 70 | 72.1 | 呈糖浆状,色棕红 |
| 75 | 70.0 | 呈糖浆状,色棕黑 |
| 80 | 58.0 | 呈糖浆状,有部分炭化色发黑 |
| 浸泡时间/小时 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 草酸收率% | 52.1 | 61.6 | 72.1 | 71.5 | 71.9 | 72.0 | 71.7 |
 步骤⑥采用的操作方法是:
步骤⑥采用的操作方法是:(3)为了确定产品中H2C2O4?2H2O的纯度,称取10.5g草酸样品,配成250mL溶液,每次实验时准确量取40.00mL草酸溶液,加入适量的稀硫酸,用0.1mol/LKMnO4标准溶液滴定.平行滴定三次,消耗KMnO4标准溶液平均为16.00mL,下列有关说法正确的是
A.KMnO4标准溶液盛放在碱式滴定管中
B.可从酸式滴定管中准确放出40.00mL草酸溶液
C.该实验不需要加指示剂
D.测得产品中的草酸晶体纯度约为95.0%
考点:纤维素的性质实验,探究物质的组成或测量物质的含量
专题:实验题
分析:(1)根据纤维素水解过程中需要硫酸做催化剂分析;根据表1、表2中草酸收率判断硫酸的最佳浓度及最佳浸泡时间;
(2)根据减压抽滤的优点进行解答;根据草酸粗品中的杂质及物质分离除杂方法分析;
(3)根据滴定管的使用方法、草酸与高锰酸钾溶液的反应方程式进行判断.
(2)根据减压抽滤的优点进行解答;根据草酸粗品中的杂质及物质分离除杂方法分析;
(3)根据滴定管的使用方法、草酸与高锰酸钾溶液的反应方程式进行判断.
解答:
解:(1)甘蔗渣的主要成分为纤维素,步骤①加入硫酸的目的是使纤维素水解,硫酸起到了催化作用;
根据表1可知,浓硫酸质量分数从60%到70%,草酸收率逐渐升高,当硫酸质量分数从70%到80%,草酸收率反而降低,所以硫酸质量分数为70%时草酸收率最高,且甘蔗浸泡效果最佳;
根据表2可知,浸泡时间从1到3小时,草酸收率逐渐升高,当浸泡时间从3到7小时,草酸收率逐渐减小,所以浸泡时间为3小时时,草酸收率最高,浸泡效果最好,
故答案为:催化剂;70%;3;
(2)减压抽滤的优点是加快过滤速度、得到较干燥的沉淀;
草酸粗品中含有杂质硝酸,可以通过重结晶的方法得到较纯净的草酸,
故答案为:快速高效;重结晶;
(3)A.高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管,KMnO4标准溶液应该盛放在酸式滴定管中,故A错误;
B.草酸溶液为酸性溶液,应该使用酸式滴定管量取,且滴定管可以读到0.01mL,所以可从酸式滴定管中准确放出40.00mL草酸溶液,故B正确;
C.草酸与酸性高锰酸钾溶液的反应中,高锰酸根离子为有色离子,反应过程中溶液出现有色变化,所以该实验不需要加指示剂,故C正确;
D.根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O可知,草酸的物质的量为:n(H2C2O4)=
n(MnO4-)=
×
×0.1mol/L×0.016L=0.025mol,10.5g草酸样品中H2C2O4?2H2O质量分数为:
×100%=30%,故D错误;
故选BC.
根据表1可知,浓硫酸质量分数从60%到70%,草酸收率逐渐升高,当硫酸质量分数从70%到80%,草酸收率反而降低,所以硫酸质量分数为70%时草酸收率最高,且甘蔗浸泡效果最佳;
根据表2可知,浸泡时间从1到3小时,草酸收率逐渐升高,当浸泡时间从3到7小时,草酸收率逐渐减小,所以浸泡时间为3小时时,草酸收率最高,浸泡效果最好,
故答案为:催化剂;70%;3;
(2)减压抽滤的优点是加快过滤速度、得到较干燥的沉淀;
草酸粗品中含有杂质硝酸,可以通过重结晶的方法得到较纯净的草酸,
故答案为:快速高效;重结晶;
(3)A.高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管,KMnO4标准溶液应该盛放在酸式滴定管中,故A错误;
B.草酸溶液为酸性溶液,应该使用酸式滴定管量取,且滴定管可以读到0.01mL,所以可从酸式滴定管中准确放出40.00mL草酸溶液,故B正确;
C.草酸与酸性高锰酸钾溶液的反应中,高锰酸根离子为有色离子,反应过程中溶液出现有色变化,所以该实验不需要加指示剂,故C正确;
D.根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O可知,草酸的物质的量为:n(H2C2O4)=
| 5 |
| 2 |
| 5 |
| 2 |
| 250mL |
| 40mL |
| 126g/mol×0.025mol |
| 10.5g |
故选BC.
点评:本题考查了探究物质的组成、测量物质的含量的方法,题目难度较大,注意掌握探究物质组成及含量的方法,明确常见化学实验基本操作方法,正确理解题干信息及生成流程为解答本题的关键.

练习册系列答案
相关题目
长期以来,人们一直认为氟的含氧酸不可能存在,但是自1971年两位美国科学家斯图查尔和阿佩里曼成功地合成次氟酸后,这种观点强烈的动摇了.他们在0℃以下将氟气从细冰上面通过,得到了毫克量的次氟酸.已知次氟酸的分子组成与次氯酸相似,且次氟酸与热水剧烈反应,生成既有氧化性又有还原性的物质的溶液.下列说法不正确的是( )
| A、次氟酸分子中原子间以共价键相结合 |
| B、次氟酸分解会产生F2 |
| C、次氟酸与热水反应可能有H2O2生成 |
| D、次氟酸的酸性可能比次氯酸强 |