题目内容
17. (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
(2)SF6分子结构中只存在S-F键.已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为-1220 kJ•mol-1
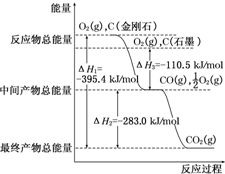
(3)金刚石和石墨在氧气不足时生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示:
①等量金刚石和石墨完全燃烧金刚石(填“金刚石”或“石墨”)放出热量更多,写出表示石墨燃烧热的热化学方程式C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1;
②在通常状况下,金刚石和石墨相比,石墨(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的△H为+1.9 kJ•mol-1生成气体36g,该过程放出的热量共252 kJ.
分析 (1)依据质量换算物质的量,结合化学方程式对应的物质的量计算反应放出的热量,依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出;
(2)根据反应热△H=反应物总键能-生成物总键能计算反应热;
(3)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=-393.5kJ?mol-1,依据极值计算判断生成的气体组成,结合热化学方程式计算过程放出的热量.
解答 解:(1)解:1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ,2mol丁烷完全燃烧并生成CO2和液态水时,放出热量为:50kJ×58×2=5800kJ,依据反应物和产物状态标注聚集状态和对应量下的反应热,书写的热化学方程式为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
(2)反应热△H=反应物总键能-生成物总键能,所以对于S(s)+3F2(g)═SF6(g),其反应热△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,
故答案为:-1220;
(3)①金刚石能量高于石墨,所以等物质的量的金刚石和石墨完全燃烧,金刚石放出热量多;能量越低越稳定,所以说明石墨稳定,石墨的燃烧热为△H=-393.5kJ?mol-1,所以石墨燃烧热的热化学方程式为:C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1,
故答案为:金刚石;C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1;
②图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析石墨转化为金刚石需要吸收热量=395.4KJ-393.5KJ=1.9KJ;反应的热化学方程式为C(石墨,s)═C(金刚石,s)△H=+1.9 kJ•mol-1;12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ;C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 ,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ•mol-1 ×0.5mol+110.5 kJ•mol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
故答案为:石墨;+1.9;252.0.
点评 本题考查了化学反应能量变化的图象分析计算,热化学方程式的书写方法,掌握基础是关键,题目难度中等.

| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大 | |
| C. | 离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △Hl<△H2<△H3 | D. | △H1>△H3>△H2 |
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
| A. | 在常温常压下,11.2 L氧气所含的分子数为0.5NA | |
| B. | 在常温常压下,1molHe的体积为22.4 L | |
| C. | 32 g氧气所含的原子数目为2NA | |
| D. | 在同温同压下,相同体积的任何气体所含的原子数相等 |
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
| A. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| B. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 | |
| C. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.04mg/L的废水,理论需用4.010-5molCl2处理 |
