题目内容
6.下列关于有机物的说法不正确的是( )| A. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| B. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 | |
| C. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
分析 A.乙醇可被氧化,乙酸具有酸性;
B.HNO3能与苯、甲苯、甘油、纤维素等有机物分别发生硝化反应、酯化反应;
C.油脂不是高分子化合物;
D.羟基、羧基、酯基都可发生取代反应,乙酸可与碳酸钠反应.
解答 解:A.乙醇具有还原性能够被氧化成乙酸,乙酸含有羧基,具有酸性,故A正确;
B.硝酸在浓硫酸催化条件下与苯、甲苯发生硝化反应,在浓硫酸催化条件下与甘油和纤维素发生酯化反应,故B正确;
C.高分子化合物的相对分子质量在10000以上,油脂不属于高分子,故C错误;
D.醇和酸的酯化反应,酯的水解反应都属于取代反应,饱和碳酸钠可以降低乙酸乙酯的溶解度,同时中和乙酸,故D正确.
故选C.
点评 本题考查较为综合,涉及有机物的组成、结构、性质以及应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
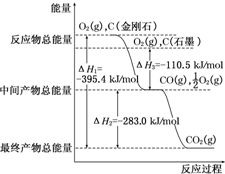
16.已知:2CO(g)+O2(g)═2CO2(g)△H=-565.2kJ•molˉ1,下列说法不正确的是( )
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
14.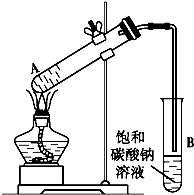 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
有关数据及副反应:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸.
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸.
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是除去乙酸乙酯中的水.
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应.
(5)炒菜时,加一点白酒和醋能使菜肴味香可口,试用符合实际情况的化学方程式解释:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸.
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是除去乙酸乙酯中的水.
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应.
(5)炒菜时,加一点白酒和醋能使菜肴味香可口,试用符合实际情况的化学方程式解释:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
11.下列说法正确的是( )
| A. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| B. | 加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖 | |
| C. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 可以用蛋白质的焰色反应,来鉴别部分蛋白质 |
18.环己酮(如图1)是一种重要的化工原料,实验室常用下列原理和装置制备(部分夹持仪器未画出)(如图2):
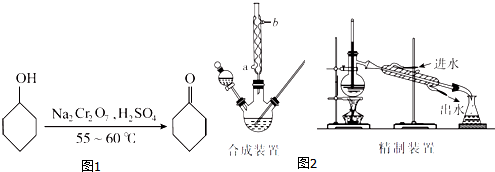
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多.实验时,先在合成装置中加入5.2 mL(5 g)环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液.酸性Na2Cr2O7溶液的加料方式为B(填代号).
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取100mL(填“100 mL”或“250 mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是环己酮和水的混合物.
(4)合成装置中冷凝管的作用是冷凝回流,冷凝水从冷凝管的a(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是降低有机物在水层得溶解度,有利于液体分层.
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集B(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒).(任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是70%.

环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取100mL(填“100 mL”或“250 mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是环己酮和水的混合物.
(4)合成装置中冷凝管的作用是冷凝回流,冷凝水从冷凝管的a(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是降低有机物在水层得溶解度,有利于液体分层.
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集B(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒).(任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是70%.
8.将物质的量均为0.1mol AlCl3、K2SO4和Al2(SO4)3溶于水,向其中加入一定量的Ba(OH)2溶液,测得溶液与沉淀中均含有铝元素,则生成BaSO4的物质的量不可能为( )
| A. | 0.2mol | B. | 0.25 mol | C. | 0.35 mol | D. | 0.45 mol |
 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
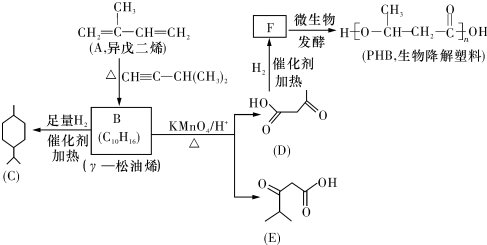
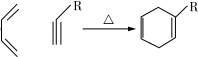
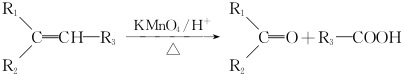
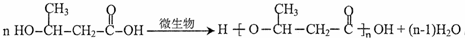 .
.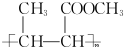 (一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是
(一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是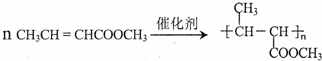 .
.