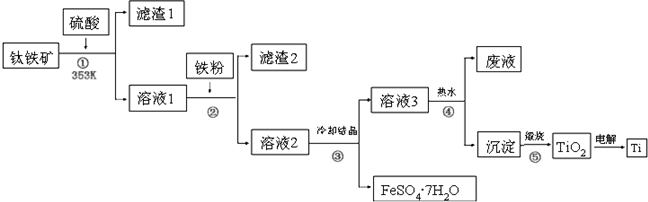
题目内容
13.欲使1L 0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是( )| A. | 加入20 g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.2 L | |
| C. | 加入10 mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
分析 A.20g氢氧化钠的物质的量为0.5mol,向1L溶液中进入0.5mol氢氧化钠固体,溶液的体积会发生变化,所以溶液浓度不等于1mol/L;
B.将溶液加热浓缩至0.2L,溶液的浓度变为原先的:$\frac{1L}{0.2L}$=5倍;
C.先计算出氢氧化钠的总物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液的浓度;
D.两溶液混合后溶液的体积会发生变化,混合液体积不等于2L.
解答 解:A.加入20g固体NaOH,搅拌、溶解,由于溶解后的溶液体积会发生变化,氢氧化钠的物质的量为1mol,但是溶液的体积不是1L,所以浓度不是1mol/L,故A错误;
B.将溶液加热浓缩至0.2L,溶液的浓度变为原先的:$\frac{1L}{0.2L}$=5倍,浓缩后溶液的浓度为:0.5mol/L×5=2.5mol/L,故B错误;
C.加入10mol/L的NaOH溶液0.1L,再稀释至1.5L,此时溶液中氢氧化钠的浓度为:c(NaOH)=$\frac{0.5mol/L×1L+10mol/L×0.1L}{1.5L}$=1mol/L,浓度变为原先的2倍,故C正确;
D.加入1L 1.5mol/L的NaOH溶液混合均匀,混合液的体积不是2.5L,所得溶液的浓度也不是 1mol/L,故D错误;
故选C.
点评 本题考查了一定物质的量浓度的溶液配制方法,题目难度不大,注意掌握物质的量浓度的概念及配制一定浓度的溶液的方法,明确溶液混合后溶液的体积不能简单的加和.

练习册系列答案
相关题目
4.下列推断合理的是( )
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | 将SO2通入品红溶液中,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
1.由CH4和O2组成的混合气体,标准状况下的密度为1g•L-1,则该混合气体中CH4和O2的质量的量之比为( )
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
18.已知反应:2NO(g)+Br2(g)?2NOBr(g)的活化能为akJ•mol-1,其反应机理如下:
①NO(g)+Br2(g)?NOBr2(g)慢
②NO(g)+NOBr2(g)?2NOBr(g)快
下列有关该反应的说法正确的是( )
①NO(g)+Br2(g)?NOBr2(g)慢
②NO(g)+NOBr2(g)?2NOBr(g)快
下列有关该反应的说法正确的是( )
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
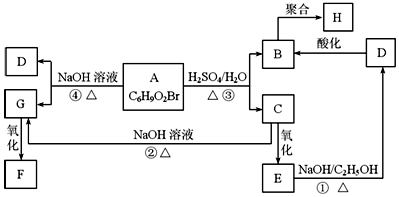 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.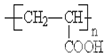 ;
;