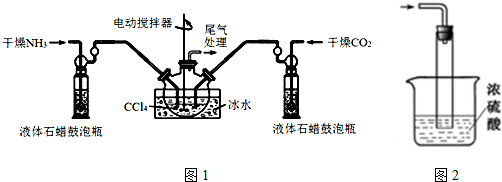
题目内容
4.下列推断合理的是( )| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | 将SO2通入品红溶液中,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
分析 A.常温下铜与浓硫酸不反应;
B.金刚石与氧气反应生成二氧化碳;
C.铝离子为弱碱阳离子,水解生成氢氧化铝胶体,具有吸附性;
D.二氧化硫与溴水发生氧化还原反应.
解答 解:A.常温下铜与浓硫酸不反应,故A错误;
B.金刚石是自然界中硬度最大的物质,能与氧气发生反应生成二氧化碳,故B错误;
C.明矾[KAl(SO4)2•12H2O]在水中水解生成Al(OH)3胶体,具有吸附性,能够吸收水中固体杂质颗粒,可用作净水剂,故C正确;
D.二氧化硫与溴水发生氧化还原反应生成无色的氢溴酸和硫酸,使溴水褪色,褪色后加热不能恢复原色,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉浓硫酸、二氧化硫、明矾、金刚石的性质是解题关键,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
19.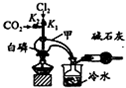 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.实验室制取PCl3的装置示意图和有关数据如下:
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥(或者通入装有干燥的有色布条的集气瓶,布条不褪色等,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,合理答案均可)(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气并防止空气中的水蒸气进入收集PCl3的仪器中.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)[已知亚磷酸(H3PO3)是二元弱酸]
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥(或者通入装有干燥的有色布条的集气瓶,布条不褪色等,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,合理答案均可)(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气并防止空气中的水蒸气进入收集PCl3的仪器中.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)[已知亚磷酸(H3PO3)是二元弱酸]
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
9.在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的为( )
| A. | 溶液中Na+数目增多 | |
| B. | 溶液中有氢气逸出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液质量减少,溶质的质量分数不变 |
13.欲使1L 0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是( )
| A. | 加入20 g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.2 L | |
| C. | 加入10 mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
7.用CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | 等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 | |
| C. | 若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |
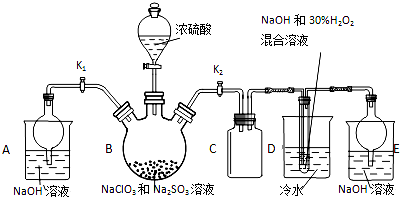 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答: