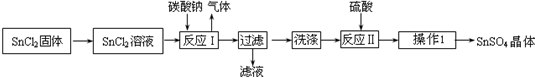
题目内容
5.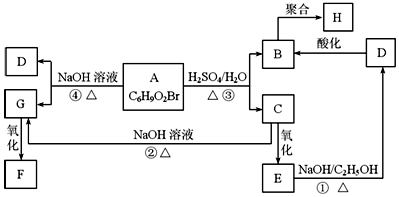 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.(1)写出物质C中的官能团的名称:溴原子、羟基;
(2)写出物质F、H的结构简式;
FHOOCCH2COOH、H
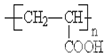 ;
;(3)写出反应④的化学反应类型:④取代(水解)反应;
(4)写出变化①的化学方程式BrCH2CH2COOH+2NaOH$→_{△}^{C_{2}H_{5}OH}$CH2=CHCOONa+NaBr+2H2O
(5)写出相对分子质量比B大14,且与B具有相同官能团的所有物质的结构简式(不考虑立体异构).CH2=CHCH2COOH或CH3CH=CHCOOH或CH2=C(CH3)COOH.
分析 A中不饱和度=$\frac{6×2+2-10}{2}$=2,A能发生水解反应说明含有酯基,根据其不饱和度知,A中还含有碳碳双键,A水解生成B、C,C能发生氧化反应,则C中含有醇羟基,B为羧酸,C氧化得E,E在氢氧化钠醇溶液中发生消去反应得D,D的分子式为C3H3O2Na,D酸化得B,则B、C中碳原子个数相等为3,E能和氢氧化钠的醇溶液发生消去反应,则C、E中含有-Br,D酸化得到B,所以B、D中含有碳碳双键,则B为CH2=CHCOOH、D为CH2=CHCOONa,B发生加聚反应生成H,A和氢氧化钠的水溶液发生水解反应生成D和G,G能发生氧化反应生成F,G为醇,且含有两个醇羟基,0.1mol F还能与足量NaHCO3反应,在标准状况下放出4.48L CO2,说明F中含有两个羧基,5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,所以F的摩尔质量为$\frac{5.2g}{0.05mol}$=104g•mol-1,则F结构简式为HOOCCH2COOH,根据转化关系可知,G结构简式为HOCH2CH2CH2OH,C为BrCH2CH2CH2OH,E为BrCH2CH2COOH,A为CH2=CHCOOCH2CH2CH2Br,此分析解答.
解答 解:A的分子式为C6H9O2Br,且能发生水解反应,说明A含有酯基,A中不饱和度=$\frac{6×2+2-10}{2}$=2,说明A中还含有碳碳双键,A在浓硫酸作用下得到C与B,C氧化生成E,E在氢氧化钠醇溶液、加热条件下生成D,D酸化生成B,而E的分子中含有羧基,D的分子式C3H3O2Na,故E中含有-Br、-COOH,C含有-OH,B中含有-COOH、碳碳双键,且B、C含有相同的碳原子数目为3,则B为CH2=CHCOOH、D为CH2=CHCOONa;E为BrCH2CH2COOH,C为BrCH2CH2CH2OH,
(1)C中的官能团的名称为溴原子、羟基,故答案为:溴原子、羟基;
(2)A在氢氧化钠的水溶液作用下发生水解反应生成D和G,G中含有羟基,C水解也得到G,故G中含有2个-OH,分子式为C3H8O2,G氧化生成F,F能和NaOH溶液反应则F为羧酸,5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,F的摩尔质量为$\frac{5.2g}{0.05mol}$=104g•mol-1,所以F为HOOCCH2COOH,B为CH2=CHCOOH,B聚合生成H,则H结构简式是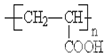 ,故答案为:HOOCCH2COOH、
,故答案为:HOOCCH2COOH、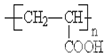 ;
;
(3)A的分子式为C6H9O2Br,为CH2=CHCOOCH2CH2CH2Br,反应④为CH2=CHCOOCH2CH2CH2Br,在氢氧化钠溶液、加热条件下水解,生成CH2=CHCOONa与HOCH2CH2CH2OH,反应方程式为CH2=CHCOOCH2CH2CH2Br+2NaOH$→_{△}^{水}$CH2=CHCOONa+HOCH2CH2CH2OH+NaBr,④为取代或水解反应,
故答案为:取代(水解)反应;
(4)E为BrCH2CH2COOH,反应①在氢氧化钠醇溶液、加热条件下,发生消去反应与中和反应,反应的化学方程式为BrCH2CH2COOH+2NaOH$→_{△}^{C_{2}H_{5}OH}$CH2=CHCOONa+NaBr+2H2O,
故答案为:BrCH2CH2COOH+2NaOH$→_{△}^{C_{2}H_{5}OH}$CH2=CHCOONa+NaBr+2H2O;
(5)B为CH2=CHCOOH,相对分子质量比B大14,且与B具有相同官能团的物质的结构简式为CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=C(CH3)COOH,
故答案为:CH2=CHCH2COOH或CH3CH=CHCOOH或CH2=C(CH3)COOH.
点评 本题考查有机物推断,侧重考查学生分析判断能力,涉及卤代烃、醇、羧酸、烯烃之间的转化,正确判断溴原子位置是解本题关键,注意有机物发生消去反应时结构特点,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 加入20 g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.2 L | |
| C. | 加入10 mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
| A. | 1L溶液中含阴、阳离子总数是0.6NA | |
| B. | 500mL溶液中Βa2+的浓度是0.2mol•L-1 | |
| C. | 500mL溶液中NO-3的浓度是0.4mol•L-1 | |
| D. | 1L溶液中含有0.2NA个NO-3 |
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | 等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 | |
| C. | 若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |

 A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:
A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系: