题目内容
16.二十一世纪钛将成为铁、铝之后的第三大金属,工业上以钛铁矿为原料制备二氧化钛及钛的工艺流程如图1所示,钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价,FeTiO3溶于酸后Ti元素以TiO2+存在,TiOSO4遇水可水解.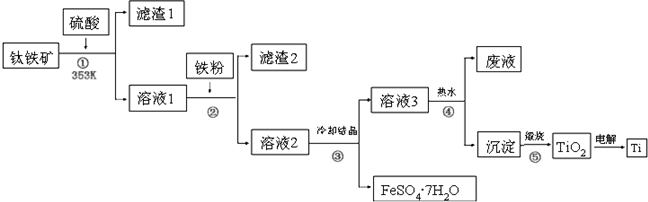
请根据以上信息回答下列问题:
(1)②中加入铁粉的目的是除去Fe3+;
(2)③中混合物分离的依据是b(填字母序号).
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)②、③、④中均需要进行的操作是过滤(填操作名称).
(4)写出④的离子方程式:TiO2++2H2O=H2TiO3+2H+;该过程在热水中操作的目的是由于水解反应吸热,升高温度有利于水解平衡向正反应方向移动,提高H2TiO3的产率
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(6)科学家从电解冶炼铝的工艺得到启发.找出了冶炼钛的新工艺.
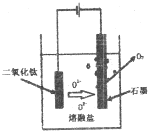
①直接电解固体TiO2法生产钛,原理如图所示,则阴极获得钛的电极反应为TiO2+4e-=Ti+2O2-.
②电解一段时间后,需要更换石墨电极,原因是氧离子在阳极失电子发生氧化反应生成氧气,碳和氧气发生反应生成一氧化碳,O2--2e-+C=CO.
分析 钛铁矿的主要成分为钛酸亚铁(FeTiO3),FeTiO3溶于硫酸后Ti元素以TiO2+存在,过滤得到溶液1,溶液1中加入铁粉还原铁离子生成亚铁离子过滤得到溶液2中含有TiO2+,FeSO4,冷却结晶过滤得到硫酸亚铁晶体和滤液3,在热水中加热析出沉淀H2TiO3,煅烧得到TiO2,电解TiO2 得到Ti,
(1)转化关系中生成的离子分析判断发生反应的物质和离子及其生成的离子,铁还原铁离子为亚铁离子;
(2)根据物质溶解度本题分析析出晶体的条件应用;
(3)依据操作过程中形成的物质溶解性和分离目的分析回答;
(4)依据二氧化锰的氧化性氧化亚铁离子分析氧化还原反应生成二价锰的化合物,结合电荷守恒和原子守恒写出;
(5)依据图示生成物质的分析,阳极生成二氧化碳,阴极析出钙,结合电解池中阳极发生氧化反应,阴极发生还原反应,写出电极反应;TiO2直接电解法生产钛,发生还原反应,二氧化钛为阴极,连接电源负极,由示意图可知二氧化钛获得电子生成Ti与氧离子;电解一段时间后,需要更换石墨电极是因为氧离子生成氧气会消耗碳.
解答 解:(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+,②中加入铁粉的目的是除去Fe3+,
故答案为:除去Fe3+;
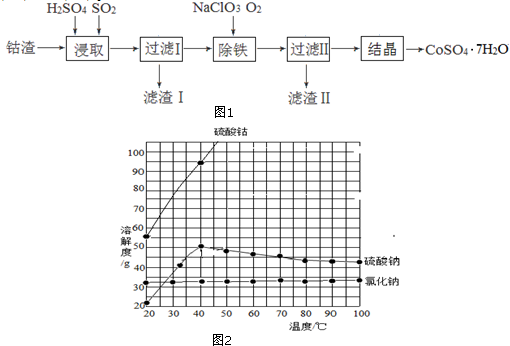
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,故答案为:b;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,
故答案为:过滤;
(4)④的离子方程式为:TiO2++2H2O=H2TiO3+2H+,④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2,该过程在热水中操作的目的是由于水解反应吸热,升高温度有利于水解平衡向正反应方向移动,提高H2TiO3的产率,
故答案为:TiO2++2H2O=H2TiO3+2H+;由于水解反应吸热,升高温度有利于水解平衡向正反应方向移动,提高H2TiO3的产率;
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)①电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连,电极反应式为TiO2+4e-=Ti+2O2-;
故答案为:TiO2+4e-=Ti+2O2-;
②电解一段时间后,需要更换石墨电极,氧离子在阳极失电子发生氧化反应生成氧气,碳和氧气发生反应生成一氧化碳,反应为O2--2e-+C=CO,
故答案为:氧离子在阳极失电子发生氧化反应生成氧气,碳和氧气发生反应生成一氧化碳,O2--2e-+C=CO;
点评 本题考查了物质制备、物质性质、实验基本操作、电解原理等知识点,掌握基础是解题关键,题目难度中等.

| A. | 加入20 g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.2 L | |
| C. | 加入10 mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | 等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 | |
| C. | 若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |

| A. | H2O分子中H-O的键能为462kJ?mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ?mol-1 | |
| C. | H2的燃烧热为240 kJ?mol-1 | |
| D. | 欲分解2molH2O(l),至少需要提供4×462kJ的热量 |
 硝基苯的实验室制备主要步骤如下:
硝基苯的实验室制备主要步骤如下: .
. +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.