题目内容
17.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:(1)常温下0.1mol•L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+)B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-)D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将减小(填“增大”“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为pH(甲)>pH(乙)(填“>”“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为V(甲)<V(乙)(填“>”“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | K1 | 1.8×10-5 | 4.2×10-7 | 3.0×10-8 |
| K2 | 5.6×10-11 | -- | ||
A.HCO3- B.CO32- C.ClO-D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
分析 (1)A.CH3COOH?CH3COO-+H+,加水稀释导致电离方程式中的三种微粒浓度均减小;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,加水稀释促进电离,导致n(H+)增大、n(CH3COOH)减小;
C.c(H+)•c(OH-)=Kw,Kw只受温度的影响;
D.醋酸溶液稀释过程导致c(H+)减小,Kw不变,由c(H+)•c(OH-)=Kw可知c(OH-)增大;
(2)醋酸是弱电解质,CH3COOH?CH3COO-+H+,加水稀释促进醋酸电离;向醋酸中加入无水醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离;
(3)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离;
(4)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积、等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大;
(5)电离平衡常数K越小,说明该酸的酸性越弱,则酸根离子结合H+能力最强,根据强酸制弱酸原理分析,电离常数越大,酸性越强,酸性:CH3COOH>H2CO3>HClO>HCO3-,
CH3COOH和少量Na2CO3溶液反应生成醋酸钠和二氧化碳,HClO和少量的Na2CO3溶液反应生成NaClO和NaHCO3.
解答 解:(1)A.CH3COOH?CH3COO-+H+,加水稀释导致电离方程式中的三种微粒浓度均减小,因此c(H+)减小,故A选;
B.加水稀释促进电离,导致n(H+)增大、n(CH3COOH)减小,因此$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,增大,故B不选;
C.c(H+)•c(OH-)=Kw,Kw只受温度的影响,不受离子浓度变化的影响,因此Kw不变,故C不选;
D.醋酸溶液稀释过程导致c(H+)减小,Kw不变,由c(H+)•c(OH-)=Kw可知c(OH-)增大,因此$\frac{c(O{H}^{-})}{C({H}^{+})}$增大,故D不选;
故答案为:A;
(2)醋酸是弱电解质,电离方程式为CH3COOH?CH3COO-+H+,加水稀释促进醋酸电离,所以醋酸电离平衡向正反应方向移动;向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,电离平衡逆向移动,导致c(H+)减小、c(CH3COOH)增大,因此$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小,
故答案为:向右;减小;
(3)氯化氢是强电解质,完全电离,稀释100倍后pH增大2个单位.醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,导致醋酸溶液稀释100倍后pH增大不到2个单位,所以盐酸的pH大于醋酸,
故答案为:>;
(4)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积、等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大,所以V(甲)<V(乙),
故答案为:<;
(5)根据表格中K的数值可知H2CO3的K2最小,说明HCO3- 的酸性最弱,因此CO32-结合H+能力最强;
电离常数越大,酸性越强,酸性:CH3COOH>H2CO3>HClO>HCO3-,
CH3COOH和少量Na2CO3溶液反应生成醋酸钠和二氧化碳,则反应的方程式为:2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;
HClO和少量的Na2CO3溶液反应生成NaClO和NaHCO3,则反应的方程式为:HClO+CO32-=ClO-+HCO3-;
故答案为:B;2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;HClO+CO32-=ClO-+HCO3-.
点评 本题考查了弱电解质的电离,难度中等,明确弱电解质和强电解质的电离特点是解题关键,注意相同浓度的不同酸稀释时其pH变化规律,结合电离平衡常数分析解答.

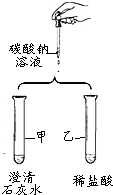 如图是某小组验证碳酸钠性质的实验方案.
如图是某小组验证碳酸钠性质的实验方案.(1)甲试管中反应的化学方程式为Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;
(2)乙试管中的现象是大量气泡.
实验后他们将废液倒入废液缸,小欣发现废液澄清.
【提出问题】废液中的溶质含有哪些成分?
【查阅资料】①CaCl2溶液呈中性
②CaCl2+Na2CO3═2NaCl+CaCO3↓
【提出猜想】可能是Ⅰ.CaCl2、NaClⅡ.CaCl2、NaCl HCl
【设计实验】验证你的猜想
| 实验步骤 | 实验现象 | 结论 |
| 取少量的废液于试管中,滴加2~3滴石蕊试液,振荡. | 无现象 | 废液的pH=7; 猜想Ⅰ成立. |
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Fe2+、Na+、Cl-、NO3- | |
| C. | Na2CO3溶液:K+、NO3-、Cl-、Al3+ | |
| D. | $\frac{{K}_{W}}{c(H)}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
| A. | 标准状况下,22.4L H20中含有的分子数为NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05NA | |
| C. | 7.lgCl2 与足量的氢氧化钠溶液反应转移的电子数一定为0.2 NA | |
| D. | 1L lmol/L CaCl2溶液中含有的氯离子数为NA |
| 选项 | 操作和现象 | 结论 |
| A | 向溶液中加入KSCN溶液无明显现象,再加入新制氯水,溶液呈血红色 | 证明原溶液中含有Fe2+ |
| B | 加入AgNO3溶液后生成白色沉淀,加稀盐酸沉淀不溶解 | 可确定有Cl-存在 |
| C | 将某种气体通入酸性KMnO4溶液.溶液褪色 | 说明该气体一定具有漂白性 |
| D | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解 | 证明该溶液中存在AlO2- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 考古时可用12C测定一些文物的年代 | |
| B. | 可在元素周期表的过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| C. | 乙烯是一种重要的基本化工原料,它的产量可以用来衡量一个国家的石油化工发展水平 | |
| D. | 红葡萄酒的密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
| A. | 产物乙的系统命名为2-甲基丁烷 | |
| B. | 烃甲可能是2-甲基-1,3-丁二烯 | |
| C. | 0.1 mol产物乙完全燃烧可消耗17.92L O2 | |
| D. | 烃甲与乙炔可能是同系物 |
