题目内容
9.0.03mol铜与120mL 1mol•L-1 HNO3充分反应,由此可知:反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
生成的气体在标准状况下的体积为0.048 L.
反应中转移电子的物质的量为0.06 mol.
反应后溶液中所含NO3-的物质的量为0.1 mol.
分析 铜与稀硝酸反应生成硝酸铜的一氧化氮与水,反应的方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;而120mL 1mol•L-1 HNO3的物质的量为:0.12×1=0.12mol,由方程式可知:0.03mol铜完全反应,所以生成0.02mol的一氧化氮,转移电子数为0.03×2=0.06mol,根据氮守恒求反应后溶液中硝酸根离子的物质的量,由此分析解答.
解答 解:铜与稀硝酸反应生成硝酸铜的一氧化氮与水,反应的方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;而120mL 1mol•L-1 HNO3的物质的量为:0.12×1=0.12mol,由方程式可知:0.03mol铜完全反应,所以生成0.02mol的一氧化氮,体积为:0.048L,转移电子数为0.03×2=0.06mol,反应后溶液中所含NO3-的物质的量为0.12-0.02=0.1mol,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;0.048; 0.06; 0.1.
点评 本题以Cu和硝酸的反应为载体考查氧化还原反应的计算,侧重考查分析计算能力,会利用原子守恒、转移电子守恒进行计算,题目难度中等.

练习册系列答案
相关题目
17.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol•L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+)B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-)D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将减小(填“增大”“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为pH(甲)>pH(乙)(填“>”“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为V(甲)<V(乙)(填“>”“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO3- B.CO32- C.ClO-D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
(1)常温下0.1mol•L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+)B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-)D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将减小(填“增大”“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为pH(甲)>pH(乙)(填“>”“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为V(甲)<V(乙)(填“>”“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | K1 | 1.8×10-5 | 4.2×10-7 | 3.0×10-8 |
| K2 | 5.6×10-11 | -- | ||
A.HCO3- B.CO32- C.ClO-D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
4.下列说法正确的是( )
| A. | CO是酸性氧化物 | B. | BaSO4 是强电解质 | ||
| C. | 氢氧化铁胶体属于纯净物 | D. | 纯碱属于碱类物质 |
14.某无色透明的酸性溶液能与铁反应生成氢气,则该溶液中一定能够大量共存的是( )
| A. | NH4+、K+、Ca2+、Cl- | B. | SO42-、Na+、Fe2+、Cl- | ||
| C. | Na+、K+、Cl-、SiO32- | D. | SO42-、NO3-、K+、Na+ |
1.氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2+O2═2H2O,正极反应为:O2+2H2O+4e-═4OH-,下列叙述不正确的是( )
| A. | H2通入负极区 | B. | O2通入正极区 | ||
| C. | 负极反应为2H2+4OH--4e-═4H2O | D. | 正极发生氧化反应 |
18.下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
| A. | NaHCO3 HCl | B. | Na2CO3 HCl | C. | AlCl3 NaOH | D. | CaCl2 Na2CO3 |
19.以下物质的制备用错实验装置的是( )
| A. | 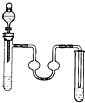 苯的溴代反应 | B. |  乙酸丁酯的制备 | C. |  苯的硝化反应 | D. |  乙炔的制取 |
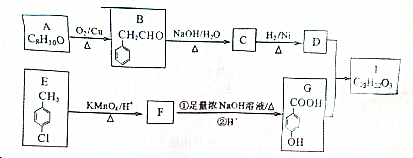
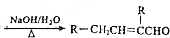
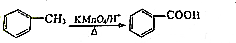
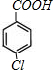 +3 NaOH$\stackrel{△}{→}$
+3 NaOH$\stackrel{△}{→}$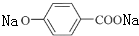 +NaCl+2H2O.
+NaCl+2H2O. (无机试剂任用).合成路线流程图示例如下:
(无机试剂任用).合成路线流程图示例如下: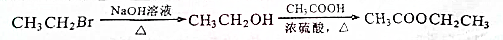
 .C2A4的水溶液呈碱(填“酸”“碱”或“中”)性,1mol C2A4最多可以与2mol HCl或NaOH发生中和反应生成正盐.C2A4 和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4 和A2D2 既具有氧化性又具有还原性的原因N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性
.C2A4的水溶液呈碱(填“酸”“碱”或“中”)性,1mol C2A4最多可以与2mol HCl或NaOH发生中和反应生成正盐.C2A4 和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4 和A2D2 既具有氧化性又具有还原性的原因N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性 ,该化合物与CA3和A2D的熔点由高到低的顺序为H2O>NH3>CH4(用化学式表示).
,该化合物与CA3和A2D的熔点由高到低的顺序为H2O>NH3>CH4(用化学式表示). .CA3、A2D、EA3的热稳定性由强到弱的顺序为H2O>NH3>PH3(用化学式表示).
.CA3、A2D、EA3的热稳定性由强到弱的顺序为H2O>NH3>PH3(用化学式表示).