题目内容
3.现有部分短周期主族元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 常温下单质能与水剧烈反应,所得溶液呈强碱性 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 第三周期元素的原子中半径最小 |
| D | D的一种同位素可测定文物年代 |
| E | 次外层电子数比最外层电子数多2个 |
(2)B元素气态氢化物的电子式是
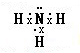 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
分析 A常温下单质能与水剧烈反应,所得溶液呈强碱性,应为Na元素;B常温下单质为双原子分子,其氢化物水溶液呈碱性,应为N元素;C第三周期元素的原子中半径最小,应为Cl元素;D的一种同位素可测定文物年代,为C元素;E次外层电子数比最外层电子数多2个,为S元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:A常温下单质能与水剧烈反应,所得溶液呈强碱性,应为Na元素;B常温下单质为双原子分子,其氢化物水溶液呈碱性,应为N元素;C第三周期元素的原子中半径最小,应为Cl元素;D的一种同位素可测定文物年代,为C元素;E次外层电子数比最外层电子数多2个,为S元素,
(1)A为Na,与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(2)气态氢化物的水溶液呈碱性的气体是NH3,其电子式为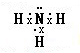 ,一水合氨在溶液中电离生成铵根离子和氢氧根离子,电离方程式为NH3•H2O?NH4++OH-,
,一水合氨在溶液中电离生成铵根离子和氢氧根离子,电离方程式为NH3•H2O?NH4++OH-,
故答案为: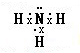 ;NH3•H2O?NH4++OH-;
;NH3•H2O?NH4++OH-;
(3)A、B、C、D、E五种元素的单质中A为Na,为金属元素,其它为非金属元素,故答案为:Na;钠是金属单质,其它的是非金属单质;
(4)N、C两元素非金属性较强的是N,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则由硝酸的酸性比碳酸强,可说明N的非金属性强,
故答案为:N;硝酸的酸性比碳酸强.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律,明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
相关题目
14.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
18.NH3溶于水,在氨的水溶液中存在这样的平衡关系NH3+H2O?NH3•H2O?NH4++OH-,下列有关500mL0.2mol•L-1氨水的叙述,正确的是( )
| A. | 含有0.1molNH3•H2O分子 | |
| B. | 溶液中NH3的物质的量浓度为0.2 mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量之和为0.2 mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量总和为0.1 mol |
8.下列四个装置所示的实验中,能达到实验目的是( )
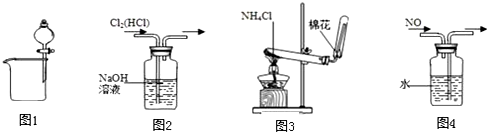

| A. | 图1可用于分离碘酒中的碘和酒精 | B. | 图2可用于除去Cl2中的HCl | ||
| C. | 图3可用于实验室制取氨气 | D. | 图4可用于排水集气法收集NO |
15.下列是某同学对相应反应的离子方程式所作的评价,其中合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH= CO2↑+H2O+2CH3COO- | 错误,碳酸钙是难溶于水,不应写成离子形式 |
| B | 甲醛和足量银氨溶液充分反应 | HCHO+2Ag(NH3)2++2OH- $\frac{\underline{\;\;△\;\;}}{\;}$HCOO-+NH${\;}_{4}^{+}$+2Ag↓+H2O | 正确 |
| C | NaHSO3溶液的水解 | HSO3-+H2O?SO32-+H3O+ | 错误,水解方程式写成了电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | 错误,Fe2+与Br-的物质的量之比与化学式不符 |
| A. | A | B. | B | C. | C | D. | D |
 .
. 某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.
某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.