题目内容
15.下列是某同学对相应反应的离子方程式所作的评价,其中合理的是( )| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH= CO2↑+H2O+2CH3COO- | 错误,碳酸钙是难溶于水,不应写成离子形式 |
| B | 甲醛和足量银氨溶液充分反应 | HCHO+2Ag(NH3)2++2OH- $\frac{\underline{\;\;△\;\;}}{\;}$HCOO-+NH${\;}_{4}^{+}$+2Ag↓+H2O | 正确 |
| C | NaHSO3溶液的水解 | HSO3-+H2O?SO32-+H3O+ | 错误,水解方程式写成了电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | 错误,Fe2+与Br-的物质的量之比与化学式不符 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钙为强电解质,是沉淀;
B.二者反应的物质的量为1:4;
C.亚硫酸电离生成亚硫酸根离子和氢离子,水解生成亚硫酸和氢氧根离子;
D.等物质的量的FeBr2和Cl2反应,亚铁离子全部被氧化,溴离子一半被氧化.
解答 解:A.碳酸钙与醋酸反应的离子反应为CaCO3+2CH3COOH=CO2↑+H2O+Ca2++2CH3COO-,碳酸钙不溶于水,但属于强电解质,故A正确;
B.甲醛和足量银氨溶液充分反应的离子反应为HCHO+4Ag(NH3)2++4OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+2NH4++4Ag↓+2H2O+6NH3,故B错误;
C.NaHSO3溶液的水解离子方程式:HSO3-+H2O?H2SO3+OH-,HSO3-+H2O?SO32-+H3O+为亚硫酸氢根离子的电离方程式,评价正确,故C正确;
D.等物质的量的FeBr2和Cl2反应,亚铁离子全部被氧化,溴离子一半被氧化,离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,评价错误,故D错误;
故选:AC.
点评 本题考查了离子方程式书写正误判断,明确反应实质是解题关键,注意化学式的拆分,注意弱酸的酸式根离子电离与水解的区别,注意二价铁离子还原性强于溴离子,题难度中等.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
3.现有部分短周期主族元素的性质或原子结构如表:
(1)写出A单质与水反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
(2)B元素气态氢化物的电子式是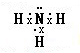 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
| 元素编号 | 元素性质或原子结构 |
| A | 常温下单质能与水剧烈反应,所得溶液呈强碱性 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 第三周期元素的原子中半径最小 |
| D | D的一种同位素可测定文物年代 |
| E | 次外层电子数比最外层电子数多2个 |
(2)B元素气态氢化物的电子式是
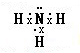 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
6.在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2mol C,经测定,D的浓度为0.5mol•L-1,下列判断正确的是( )
| A. | B的转化率为20% | |
| B. | 平衡时A的浓度为1.50 mol•L-1 | |
| C. | x=1 | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85% |
3.下列化学用语正确的是( )
| A. | CO2的电子式: | B. | Mg2+的结构示意图: | ||
| C. | Na2O的电子式:Na+2 | D. | N2的结构式:N≡N |
10.无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | SiO32-、Br-、K+、Na+ | B. | NH4+、SO42-、Cl-、NO3- | ||
| C. | K+、Na+、ClO-、Cl- | D. | K+、SO42-、HCO3-、Mg2+ |
20.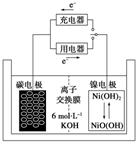 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时电池正极的电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时K+移向负极 | |
| C. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| D. | 该电池充电时将碳电极与电源的正极相连 |
7.下列说法中,不正确的是( )
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成了一层致密的氧化膜
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性.
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成了一层致密的氧化膜
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性.
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④⑤ |
5.下列说法正确的是( )
| A. | 2mol钠与过量盐酸反应生成NA个H2分子 | |
| B. | 金属钠加到冷水中,反应的离子方程式是:Na+2H2O═Na++OH-+H2↑ | |
| C. | 1molNa2O2与足量的水反应,转移电子数为2NA个 | |
| D. | 为测定熔融NaOH的导电性,可在瓷坩埚中熔化NaOH固体后进行测量 |

 .
.