题目内容
14.下列物质的电子式书写正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、溴化铵为离子晶体,由铵根离子与溴离子通过离子键结合在一起;
B、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
C、过氧化钠是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
D、MgS由镁离子和硫离子构成.
解答 解:A、溴化铵是离子化合物,由铵根离子与溴离子构成,电子式为 ,故A错误;
,故A错误;
B、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故B错误;
,故B错误;
C、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 ,故C正确;
,故C正确;
D、MgS由镁离子和硫离子构成,故电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了常见的化合物的电子式的书写,难度不大,应注意的是共价化合物和离子化合物的电子式的书写方式的区别.

练习册系列答案
相关题目
4.向50ml物质的量浓度均为0.1mol/L (NH4)2SO4、Al2(SO4)3溶液中逐滴滴入0.1mol/L Ba(OH)2溶液200ml,随着Ba(OH)2溶液体积的变化,沉淀总物质的量(n)的变化如图所示.下列叙述不正确的是( )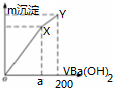

| A. | a=150 | |
| B. | Y点对应溶液为氨水 | |
| C. | OX、XY两段沉淀种类相同 | |
| D. | 继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O |
5.下列有关叙述正确的是( )
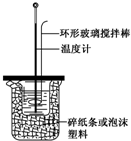

| A. | 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mL 0.50 mol•L-1的硫酸充分反应,两反应测定的中和热不相等 | |
| C. | 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应 | |
| D. | 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替 |
2.有下列物质:①石墨 ②铜丝 ③氧气 ④二氧化碳 ⑤NaCl固体 ⑥稀H2SO4 ⑦水 ⑧硫酸钡 ⑨金刚石,以下组合正确的是( )
| A. | 能导电的有①②⑤⑥ | |
| B. | 属于电解质的有⑤⑦⑧ | |
| C. | 属于强电解质的有⑤⑥⑧ | |
| D. | 既不属于电解质又不属于非电解质的有①②③④ |
9.下列实验操作与实验目的相对应的是( )
| 实验操作 | 实验目的 | |
| A | 打开分液漏斗开关,使蒸馏水滴到烧瓶中的电石上 | 制备乙炔气体 |
| B | 乙醇中有少量水,加入生石灰充分搅拌后蒸馏 | 除去乙醇中的水 |
| C | 加入过量饱和溴水 | 检验苯中是否含有苯酚 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
19.下列叙述正确的是( )
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 煤的干馏和气化都是物理变化 | |
| C. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
6.向35.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.3L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为49g.下列有关说法正确的是( )
| A. | Cu与Cu2O 的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.6mol/L | |
| C. | 产生的NO在标准状况下的体积为4.48L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
3.现有部分短周期主族元素的性质或原子结构如表:
(1)写出A单质与水反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
(2)B元素气态氢化物的电子式是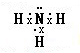 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
| 元素编号 | 元素性质或原子结构 |
| A | 常温下单质能与水剧烈反应,所得溶液呈强碱性 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 第三周期元素的原子中半径最小 |
| D | D的一种同位素可测定文物年代 |
| E | 次外层电子数比最外层电子数多2个 |
(2)B元素气态氢化物的电子式是
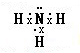 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
6.在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2mol C,经测定,D的浓度为0.5mol•L-1,下列判断正确的是( )
| A. | B的转化率为20% | |
| B. | 平衡时A的浓度为1.50 mol•L-1 | |
| C. | x=1 | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85% |