题目内容
15.已知8.8克的CO2,它的物质的量是0.2mol,含氧原子的个数约是0.4NA,在标准状况下的体积约为4.48L.分析 依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$结合1个二氧化碳含有2个氧原子解答.
解答 解:8.8克的CO2,物质的量=$\frac{8.8g}{44g/mol}$=0.2mol,含氧原子的个数约=0.2mol×2×NA=0.4NA,标况下体积V=0.2mol×22.4L/mol=4.48L;
故答案为:0.2mol;0.4NA;4.48L.
点评 本题考查了物质的量的有关计算,熟悉以物质的量为核心的计算公式是解题关键,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
5.下列有关叙述正确的是( )
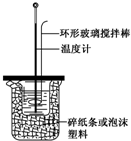

| A. | 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mL 0.50 mol•L-1的硫酸充分反应,两反应测定的中和热不相等 | |
| C. | 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应 | |
| D. | 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替 |
6.向35.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.3L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为49g.下列有关说法正确的是( )
| A. | Cu与Cu2O 的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.6mol/L | |
| C. | 产生的NO在标准状况下的体积为4.48L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
3.现有部分短周期主族元素的性质或原子结构如表:
(1)写出A单质与水反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
(2)B元素气态氢化物的电子式是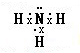 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
| 元素编号 | 元素性质或原子结构 |
| A | 常温下单质能与水剧烈反应,所得溶液呈强碱性 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 第三周期元素的原子中半径最小 |
| D | D的一种同位素可测定文物年代 |
| E | 次外层电子数比最外层电子数多2个 |
(2)B元素气态氢化物的电子式是
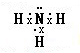 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
10.等物质的量的甲酸、乙酸及甘油(如图 )混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)( )
)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)( )
 )混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)( )
)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
6.在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2mol C,经测定,D的浓度为0.5mol•L-1,下列判断正确的是( )
| A. | B的转化率为20% | |
| B. | 平衡时A的浓度为1.50 mol•L-1 | |
| C. | x=1 | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85% |