题目内容
8.下列四个装置所示的实验中,能达到实验目的是( )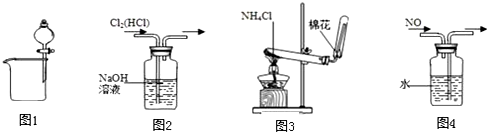
| A. | 图1可用于分离碘酒中的碘和酒精 | B. | 图2可用于除去Cl2中的HCl | ||
| C. | 图3可用于实验室制取氨气 | D. | 图4可用于排水集气法收集NO |
分析 A.碘和酒精混溶;
B.二者都与氢氧化钠溶液反应;
C.氯化铵分解生成氨气和氯化氢,在温度稍低时又生成氯化铵;
D.NO不溶于水,且与水不反应,可用排水法收集.
解答 解:A.碘和酒精混溶,不能用分液的方法分离,故A错误;
B.二者都与氢氧化钠溶液反应,应用饱和食盐水除杂,故B错误;
C.氯化铵分解生成氨气和氯化氢,在温度稍低时又生成氯化铵,应用氯化铵和氢氧化钙反应制备氨气,故C错误;
D.NO不溶于水,且与水不反应,可用排水法收集,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制取、物质的分离等,把握实验原理及实验装置图的作用为解答的关键,注意方案的合理性、操作性分析,题目难度不大.

练习册系列答案
相关题目
19.下列叙述正确的是( )
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 煤的干馏和气化都是物理变化 | |
| C. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
16.下列说法正确的是( )
| A. | 可用焰色反应来证明某试样中是否含有钠元素 | |
| B. | 至少用二种试剂通过化学反应能区别开硫酸铵、硫酸钾、氯化铵 | |
| C. | 配制物质的量溶液定容时,加水超过刻度线,用胶头滴管吸出 | |
| D. | 粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶 |
3.现有部分短周期主族元素的性质或原子结构如表:
(1)写出A单质与水反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
(2)B元素气态氢化物的电子式是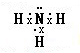 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
| 元素编号 | 元素性质或原子结构 |
| A | 常温下单质能与水剧烈反应,所得溶液呈强碱性 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 第三周期元素的原子中半径最小 |
| D | D的一种同位素可测定文物年代 |
| E | 次外层电子数比最外层电子数多2个 |
(2)B元素气态氢化物的电子式是
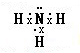 ,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
,该氢化物溶于水,水溶液呈碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.(3)探寻物质的性质差异性是学习的重要方法之-.A、B、C、D、E五种元素的单质中化学性质明显不同于其它四种单质的是Na(用化学式表示),理由钠是金属单质,其它的是非金属单质.
(4)B、D两元素非金属性较强的是(写元素符号)N.写出证明这一结论的一个实验事实硝酸的酸性比碳酸强.
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L的CCl4中含CCl4分子数为NA | |
| B. | 5.6g 铁和6.4g 铜分别与0.1mol 氯气完全反应,转移的电子数相等 | |
| C. | 0.1mol•L-1MgCl2溶液中含Cl-数为0.2NA | |
| D. | 3.9g Na2O2晶体中含有的离子总数为0.2NA |
20.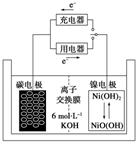 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时电池正极的电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时K+移向负极 | |
| C. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| D. | 该电池充电时将碳电极与电源的正极相连 |