题目内容
1.对于容积不变的密闭容器发生中的可逆反应:mX(g)+nY(s)?pZ(g)△H<0,达到平衡后,改变条件,下列表述不正确的是( )| A. | 增大压强,化学平衡不一定移动 | |
| B. | 通入氦气,化学平衡一定不发生移动 | |
| C. | 增加X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
分析 A.通过改变体积增大压强,对反应前后气体体积变化的化学平衡移动有影响;
B.恒温恒容下,通入氦气,平衡体系各组分的浓度不变,平衡不移动;
C.Y为固体,增大Y的用量,平衡不移动;
D.升高温度平衡向吸热反应方向移动.
解答 解:A.通过改变体积增大压强,若反应前后气体的体积不变,平衡不移动,若反应前后气体的体积发生变化,平衡发生移动,故A正确;
B.恒温恒容下,通入氦气,平衡体系各组分的浓度不变,平衡不移动,故B正确;
C.Y为固体,增大Y的用量,平衡不移动,故C错误;
D.正反应为放热反应,升高温度平衡向逆反应方向移动,故D正确.
故选C.
点评 本题考查外界条件对化学平衡移动的影响,为高频考点,难度不大,注意压强对平衡移动的影响本质是影响物质的浓度,通入稀有气体不影响浓度平衡不移动.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
12.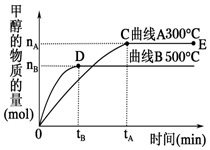 一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )
一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )
 一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )
一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡常数K(300℃)<K(500℃) | |
| B. | 500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{nB}{3tB}$ mol•L-1•min-1 | |
| C. | 在其他条件不变的情况下,将处于E点的体系的容积压缩到原来的$\frac{1}{2}$,氢气的浓度减小 | |
| D. | 300℃,当容器内压强不变时说明反应已经达到平衡 |
6.0.1mol/L氨水溶液在稀释过程中,始终保持增大趋势的是( )
| A. | OH-的物质的量 | B. | c(H+) c(OH-) | C. | c(NH4+) | D. | c(OH-) |
10.类比推理是化学中常用的思维方法.下列推理正确的是( )
| A. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| B. | CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液也不反应 | |
| C. | CO2是直线型分子,推测CS2也是直线型分子 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
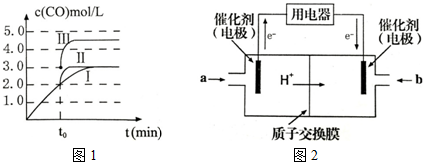
11. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时将电能转化为化学能 | B. | 电子从电极b经外电路流向电极a | ||
| C. | 该电池中的电极b是正极 | D. | 在电极a上发生氧化反应 |
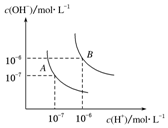 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).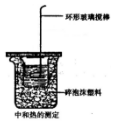 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验