题目内容
10.同主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱顺序是:H3XO4<H3YO4<H3ZO4,下列推断中正确的是( )| A. | 元素的非金属性:X>Y>Z | B. | 气态氢化物的稳定性:XH3>YH3>ZH3 | ||
| C. | 原子半径:X<Y<Z | D. | 相对原子质量:X>Y>Z |
分析 同主族元素从上到下原子半径增大、元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,而非金属性越强,对应氢化物越稳定.
解答 解:A.同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,根据酸性相对强弱:H3XO4<H3YO4<H3ZO4,可知非金属性X<Y<Z,故A错误;
B.非金属性X<Y<Z,则氢化物稳定性:XH3<YH3<ZH3,故B错误;
C.非金属性X<Y<Z,同主族元素从上到下原子半径增大、元素的非金属性逐渐减弱,故原子半径X>Y>Z,故C错误;
D.非金属性X<Y<Z,则原子序数X>Y>Z,同主族从上到下相对原子质量增大,故D正确.
故选:D.
点评 本题考查了同主族元素性质的相似性和递变性,同主族从上到下原子的半径逐渐增大、金属性增强而非金属性减弱,熟练掌握金属性、非金属性强弱比较方法.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 1mol甲烷(CH4)分子中所含电子数为9NA | |
| B. | 24g镁原子的最外层电子数为NA | |
| C. | 在标准状况下,1 mol H2和1mol H2O所占的体积都约是22.4L | |
| D. | 在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量2mol |
1.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个N2分子与NA个CO分子的质量比为1﹕1 | |
| B. | 水的摩尔质量等于NA个水分子的质量 | |
| C. | 在常温常压下,11.2LSO2含有的分子数为0.5NA | |
| D. | 1L 0.1mol•L-1Na2SO4溶液中有0.1NA个Na+ |
19.芳香烃是指( )
| A. | 分子中有一个或多个苯环的化合物 | |
| B. | 分子组成满足通式CnH2n-6(n≥6)的化合物 | |
| C. | 分子中含有苯环的烃 | |
| D. | 苯及苯的同系物的总称 |
20.①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠,1mol上述固体物质长期放置于空气中,下列说法正确的是( )
| A. | 质量增加的情况是②>①>③>④ | |
| B. | 质量增加的情况是①>③>④>② | |
| C. | 上述物质都有发生了氧化还原反应 | |
| D. | 过氧化钠在反应中转移了2 mol电子 |
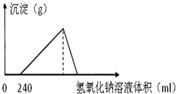 将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算: