题目内容
20.①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠,1mol上述固体物质长期放置于空气中,下列说法正确的是( )| A. | 质量增加的情况是②>①>③>④ | |
| B. | 质量增加的情况是①>③>④>② | |
| C. | 上述物质都有发生了氧化还原反应 | |
| D. | 过氧化钠在反应中转移了2 mol电子 |
分析 ①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠,化合价没有变化,不属于氧化还原反应;
②氢氧化钠与二氧化碳反应生成碳酸钠,化合价没有变化,不属于氧化还原反应;
③过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠,化合价发生变化,属于氧化还原反应;
④亚硫酸钠和氧气反应生成硫酸钠,化合价发生变化,属于氧化还原反应,Na2SO3~Na2SO4,1molNa2SO3转移了2mol电子,以此解答该题.
解答 解:①氧化钠和水反应生成氢氧化钠,二氧化碳和氢氧化钠反应生成碳酸钠;Na2O~Na2CO3;1molNa2O反应最后增加1molCO2的质量为 44g,化合价没有变化,不属于氧化还原反应;
②氢氧化钠与二氧化碳反应生成碳酸钠;NaOH~$\frac{1}{2}$Na2CO3,1molNaOH反应最后增重53-40=13g,不是氧化还原反应;
③过氧化钠和水反应生成氢氧化钠,与二氧化碳反应生成碳酸钠;Na2O2~Na2CO3,1molNa2O2反应最后增加1molCO的质量为28g,1mol过氧化钠在反应中转移了1 mol电子;
④亚硫酸钠和氧气反应生成硫酸钠;Na2SO3~Na2SO4,1molNa2SO3反应后增重16g,所以增重为①>③>④>②,
综合以上分析,只有B正确,
故选B.
点评 本题考查钠及其化合物性质的应用,为高频考点,侧重于学生的分析、计算能力的考查,明确变化过程中的质量变化计算是解答本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.同主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱顺序是:H3XO4<H3YO4<H3ZO4,下列推断中正确的是( )
| A. | 元素的非金属性:X>Y>Z | B. | 气态氢化物的稳定性:XH3>YH3>ZH3 | ||
| C. | 原子半径:X<Y<Z | D. | 相对原子质量:X>Y>Z |
11.(已知lg 2=0.3)常温下 pH=12的NaOH和pH=4的HCl等体积混合,溶液的pH为( )
| A. | 7 | B. | 10 | C. | 4.3 | D. | 11.7 |
15.下列关于乙烯的化学性质的叙述中,不正确的是( )
| A. | 能使溴水褪色 | B. | 不能发生加成反应 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能发生氧化反应 |
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧的原子结构示意图: | |
| C. | NaCl的电子式: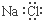 | |
| D. | 质量数为37的氯原子:${\;}_{34}^{17}$Cl |
9.下列叙述中,正确的是( )
| A. | 某物质只含一种元素,则该物质一定是纯净物 | |
| B. | 具有相同质子数的粒子一定属于同一种元素 | |
| C. | 任何原子都是由质子、中子和电子构成 | |
| D. | 溶液、胶体都是混合物 |
18.下列物质不含有共价键的是( )
| A. | NaCl | B. | CO2 | C. | NaOH | D. | O3 |