题目内容
20.下列说法正确的是( )| A. | 1mol甲烷(CH4)分子中所含电子数为9NA | |
| B. | 24g镁原子的最外层电子数为NA | |
| C. | 在标准状况下,1 mol H2和1mol H2O所占的体积都约是22.4L | |
| D. | 在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量2mol |
分析 A、甲烷为10电子微粒;
B、求出镁的物质的量,然后根据镁的最外层有2个电子来分析;
C、标况下水为液体;
D、求出混合气体的物质的量,然后根据氮气和N2O中均含2个氮原子来分析.
解答 解:A、甲烷为10电子微粒,故1mol甲烷中含10NA个电子,故A错误;
B、24g镁的物质的量为1mol,而镁的最外层有2个电子,故1mol镁的最外层有2NA个电子,故B错误;
C、标况下水为液体,故不能根据气体摩尔体积来计算其体积,故C错误;
D、标况下22.4L混合气体的物质的量为1mol,而氮气和N2O中均含2个氮原子,故1mol混合气体中含2mol氮原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
11.下列分子式只表示一种物质的是( )
| A. | C6H12O6 | B. | (C6H10O5)n | C. | C12H22O11 | D. | CF2Cl2 |
12.下列选用的相关仪器符合实验要求的是( )
| A. | 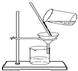 分离FeCl3溶液和蔗糖溶液 | B. |  称量8.55g氯化钠固体 | ||
| C. | 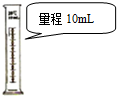 量取9.50 mL水 | D. | 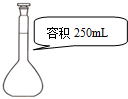 配制240 mL 0.1mol/L的NaCl溶液 |
9.化学与生活密切相关,下列有关说法正确的是( )
| A. | 用聚氯乙烯塑料袋包装食品 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |
10.同主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱顺序是:H3XO4<H3YO4<H3ZO4,下列推断中正确的是( )
| A. | 元素的非金属性:X>Y>Z | B. | 气态氢化物的稳定性:XH3>YH3>ZH3 | ||
| C. | 原子半径:X<Y<Z | D. | 相对原子质量:X>Y>Z |
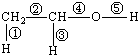 (1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答:
(1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答: .合成M的一种途径如下:
.合成M的一种途径如下:
 .
. .
. .
.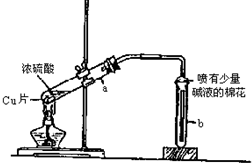 如图为浓硫酸与铜反应的实验装置图.
如图为浓硫酸与铜反应的实验装置图.