题目内容
2.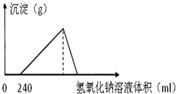 将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:(1)最大沉淀的质量.
(2)沉淀最大时耗用多少毫升氢氧化钠溶液?
(3)当沉淀从最大值到恰好完全消失时,耗用多少毫升的氢氧化钠溶液?
(4)原盐酸溶液的物质的量浓度是多少?
分析 从图中能得到的信息:盐酸溶解铝是过量的,所以加入氢氧化钠以后先中和过量的盐酸,然后才与铝离子沉淀;至氢氧化铝完全沉淀后,再溶解成NaAlO2,由此分析解答.
解答 解:(1)根据铝守恒可知:Al2O3 ~2Al(OH)3
102 2×78
5.1g m
所以$\frac{102}{5.1g}=\frac{2×78}{m}$,解之得:m=7.8g,答:最大沉淀的质量为:7.8g;
(2)Al2O3~8NaOH~2AlO2-
102 8
5.1g n(NaOH)
$\frac{102}{5.1}=\frac{8}{n(NaOH)}$解之得:n(NaOH)=0.4mol,
V(NaOH)=$\frac{0.4mol}{0.5mol/L}$=0.8L=800mL,其中沉淀铝占$\frac{3}{4}$,溶解铝占$\frac{1}{4}$,沉淀最大时消耗NaOH为V=240mL+800mL×$\frac{3}{4}$=840mL,答:沉淀最大时耗用840毫升氢氧化钠溶液;
(3)当沉淀从最大值到恰好完全消失时,耗用氢氧化钠溶液的体积为800mL×$\frac{1}{4}$=200mL,答:当沉淀从最大值到恰好完全消失时,耗用200mL的氢氧化钠溶液;
(4)最大沉淀时,溶液是单一溶质NaCl,此时n(HCl)=n(NaOH),c(HCl)=$\frac{840mL×1{0}^{-3}L/ml×0.5mol/L}{500mL×1{0}^{-3}L/mL}$=0.84mol/L,
答:盐酸溶液的物质的量浓度是0.84mol/L.
点评 本题是化学反应图象形式考查混合物计算,明确各解得发生的反应是关键,综合考查学生分析计算能力,注意利用守恒进行的解答,难度中等.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. |  分离FeCl3溶液和蔗糖溶液 | B. |  称量8.55g氯化钠固体 | ||
| C. |  量取9.50 mL水 | D. | 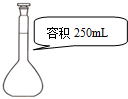 配制240 mL 0.1mol/L的NaCl溶液 |
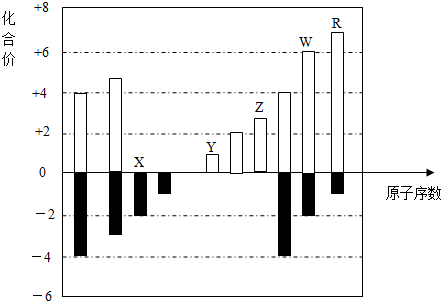
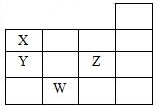 如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )
如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性为Y<Z
③W的单质是半导体材料
④W的原子序数比Y大9.
| A. | 只有③ | B. | 只有①③ | C. | 只有①②③ | D. | ①②③④ |
| A. | 元素的非金属性:X>Y>Z | B. | 气态氢化物的稳定性:XH3>YH3>ZH3 | ||
| C. | 原子半径:X<Y<Z | D. | 相对原子质量:X>Y>Z |
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | O22-和S2-具有相同的质子数和电子数 |
| A. | 7 | B. | 10 | C. | 4.3 | D. | 11.7 |
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧的原子结构示意图: | |
| C. | NaCl的电子式: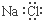 | |
| D. | 质量数为37的氯原子:${\;}_{34}^{17}$Cl |
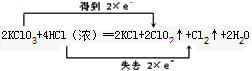 .
.