题目内容
3.有关X、Y、Z、W四种短周期元素性质的数据如表:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | X和Y能形成多种共价化合物 | |
| B. | 最简单氢化物的沸点:X>Y | |
| C. | 工业上常用电解Z的氯化物水溶液的方法制备Z单质 | |
| D. | Z和W的氧化物均能溶于Y的最高价氧化物对应的水化物溶液中 |
分析 X、Y、Z、W四种短周期元素,X、Y的半径小于Z、W的半径,结合元素的化合价可知,X为O,Y为N,Z、W为第三周期的显正价的金属,则W为Mg,Z为Al,然后结合元素化合物及元素周期律知识来解答.
解答 解:由上述分析可知,X为O,Y为N,W为Mg,Z为Al,
A.X和Y能形成NO、NO2、N2O4等多种共价化合物,故A正确;
B.水、氨气分子间均含氢键,但水中氢键数目多,则X的简单气态氢化物的沸点高于Y的简单气态氢化物,故B正确;
C.电解Z的氯化物为氯化铝,为共价化合物,电解溶液时生成氢氧化铝、氢气、氯气,应电解熔融氧化铝制备Al单质,故C错误;
D.氧化镁、氧化铝都可与硝酸反应生成对应的硝酸盐,故D正确.
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子半径、化合价及短周期推断元素为解答本题的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
13.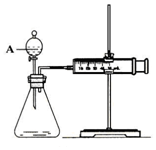 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
(1)检查该装置气密性的方法是将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好.
(2)仪器A的名称是分液漏斗.
(3)0-t时间段与t-2t时间段,化学反应速率最快的是t-2t,原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0,1mol/LFeCl3、0.2mol/LCuCl2,完成表的实验设计:
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目: .
.
②上表中需要添加的物质是4mlFeCl3溶液.
③本实验需要测定的数据是收集相同体积的氧气所需时间(或相同时间产生氧气的体积).
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如表.
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而加快(填“加快”、“减慢”或“不变”).
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入0.3 g的MnO2为较佳选择.
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?不正确(填“正确”或“不正确”),理由是H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多.(提示:H2O2溶液的密度可认为近似相等.)
 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表| 时间/s | 0 | t | 2t | … |
| 活塞的位置/ml | 17.3 | 25.6 | 36.6 | … |
(2)仪器A的名称是分液漏斗.
(3)0-t时间段与t-2t时间段,化学反应速率最快的是t-2t,原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0,1mol/LFeCl3、0.2mol/LCuCl2,完成表的实验设计:
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
 .
.②上表中需要添加的物质是4mlFeCl3溶液.
③本实验需要测定的数据是收集相同体积的氧气所需时间(或相同时间产生氧气的体积).
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如表.
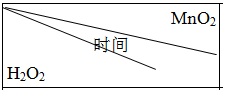 | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 36s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而加快(填“加快”、“减慢”或“不变”).
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入0.3 g的MnO2为较佳选择.
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?不正确(填“正确”或“不正确”),理由是H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多.(提示:H2O2溶液的密度可认为近似相等.)
14.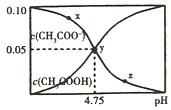 常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )
常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )
 常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )
常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )| A. | 溶液的pH比较:x>y>z | |
| B. | 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| C. | 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 | |
| D. | 该温度下,CH3COONa的Kb=10-4.75 |
11.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 一定条件下,将1mol N2和3mol H2混合发生反应,转移的电子总数为6NA | |
| B. | 30g SiO2中含有的硅氧键数为NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2mol Fe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 取50 mL 14.0 mol•L-1 浓硝酸与足量的铜片反应,生成气体分子的数目可能为0.25NA |
18.下列关于有机化合物的说法正确的是( )
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 | |
| D. | 乙酸溶于水可以电离,属于离子化合物 |
8.关于小苏打溶液的表述错误的是( )
| A. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | B. | c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-) | ||
| C. | HCO3-的电离程度小于其水解程度 | D. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
15.有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,它们的物质的量浓度均为0.1mol•L-1,下列说法正确的是( )
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若向3种溶液都通入足量二氧化碳,pH变化最大的是② | |
| C. | 若分别加入25mL0.1mol•L-1盐酸后,pH最小的是③ | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③ |
6.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质 |
