题目内容
 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
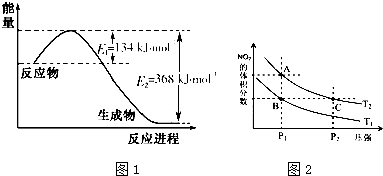
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.(1)如图1是1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式:
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②试判断K1
③下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应2NO2(g)?N2O4(g);△H<0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点NO2的转化率:A<C
d.由状态B到状态A,可以用加热的方法.
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
②根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
③直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
(3)a、压强增大,化学反应速率会加快;
b、根据B、C两点各组分浓度相等,气体总物质的量不变判断;
c、加压平衡正向移动,二氧化氮转化率增大;
d、根据温度对化学平衡的影响来回答.
(2)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
②根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
③直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
(3)a、压强增大,化学反应速率会加快;
b、根据B、C两点各组分浓度相等,气体总物质的量不变判断;
c、加压平衡正向移动,二氧化氮转化率增大;
d、根据温度对化学平衡的影响来回答.
解答:
解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;-760.3kJ/mol;
(2)①可逆反应N2(g)+3H2(g)?2NH3(g)的化学平衡常数表达式k=
,
故答案为:
;
②N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2,故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选c;
(3)解:a、C点的压强大于A点的压强,压强越大,化学反应速率越快,所以反应速率C>A,故a错误;
b、B、C两点各组分浓度相等,气体总物质的量相等,平均相对分子质量相等,故b错误;
c、从A到C,二氧化氮的体积分数减小,平衡正向移动,NO2的转化率:A<C,故C正确;
D、从B到A,二氧化氮的体积分数增大,平衡逆向移动,所以是温度降低的结果,故d错误;
故选c.
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;-760.3kJ/mol;
(2)①可逆反应N2(g)+3H2(g)?2NH3(g)的化学平衡常数表达式k=
| [NH3]2 |
| [N2]?[H2]3 |
故答案为:
| [NH3]2 |
| [N2]?[H2]3 |
②N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2,故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选c;
(3)解:a、C点的压强大于A点的压强,压强越大,化学反应速率越快,所以反应速率C>A,故a错误;
b、B、C两点各组分浓度相等,气体总物质的量相等,平均相对分子质量相等,故b错误;
c、从A到C,二氧化氮的体积分数减小,平衡正向移动,NO2的转化率:A<C,故C正确;
D、从B到A,二氧化氮的体积分数增大,平衡逆向移动,所以是温度降低的结果,故d错误;
故选c.
点评:本题主要考查了热化学方程式的书写、化学平衡常数、化学平衡的图象、平衡状态的判断等,题目难度中等,侧重对学生能力的考查.

练习册系列答案
相关题目
一元强酸和一元强碱恰好完全中和时,两者一定相等的是( )
| A、质量 |
| B、溶液的体积 |
| C、物质的量浓度 |
| D、H+和OH-的物质的量 |
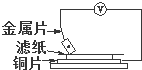 将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:| 金属 | 电流方向 | 电压/V |
| A | Cu→A | +0.78 |
| B | B→Cu | -0.30 |
| C | Cu→C | +1.35 |
| D | Cu→D | +0.15 |
| A、金属性由强到弱的顺序为:C>A>B>D |
| B、金属B不能从CuSO4溶液中置换出单质铜 |
| C、放金属C时铜片上发生的反应为:Cu-2e-=Cu2+ |
| D、金属D表面反应为:O2+2H2O+4e-=4OH- |
一种瑞香素的衍生物的结构简式如图,下列有关该有机物性质的说法正确的是( )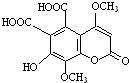

| A、能与FeCl3溶液发生显色反应 |
| B、1mol该有机物最多可与3molH2加成 |
| C、1mol该有机物最多可与含5molNaOH的溶液反应 |
| D、1mol该有机物与足量NaHCO3溶液反应可放出3molCO2 |

 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.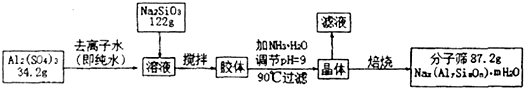
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验: