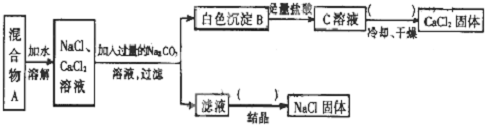
题目内容
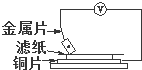 将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:| 金属 | 电流方向 | 电压/V |
| A | Cu→A | +0.78 |
| B | B→Cu | -0.30 |
| C | Cu→C | +1.35 |
| D | Cu→D | +0.15 |
| A、金属性由强到弱的顺序为:C>A>B>D |
| B、金属B不能从CuSO4溶液中置换出单质铜 |
| C、放金属C时铜片上发生的反应为:Cu-2e-=Cu2+ |
| D、金属D表面反应为:O2+2H2O+4e-=4OH- |
考点:探究原电池及其工作原理
专题:
分析:A、根据电子的流向判断电极材料与铜的金属性强弱;根据电压表的度数判断A、B、C、D的金属性强弱;
B、活泼金属可以将不活泼金属从其盐中置换出来;
C、根据原电池的工作原理确定电极反应;
D、根据原电池的工作原理确定电极反应.
B、活泼金属可以将不活泼金属从其盐中置换出来;
C、根据原电池的工作原理确定电极反应;
D、根据原电池的工作原理确定电极反应.
解答:
解:原电池中,电子流向和电流流向相反,电子从负极流向正极,负极金属的活泼性一般要大于正极金属的.
A-Cu连接时,电子从A→Cu,所以A的金属性大于铜;
B-Cu连接时,电子从Cu→B,所以铜的金属性大于B;
C-Cu连接时,电子从C→Cu,所以C的金属性大于铜;
D-Cu连接时,电子从D→Cu,所以D的金属性大于铜;
所以最不活泼的是B,其次是Cu,根据A、C、D的电压数据,知道压出越大,金属的活泼性差距越大,所以活泼性:C>A>D.,即金属的活泼性顺序是:C>A>D>Cu>B.
A、金属性由强到弱的顺序为:C>A>D>B,故A错误;
B、金属B的活泼性弱于铜,所以金属B不能从CuSO4溶液中置换出单质铜,故B正确;
C、放金属C时,金属C的活泼性强于Cu,所以C是负极,Cu是正极,正极铜片上发生得电子的还原反应O2+2H2O+4e-=4OH-,故C错误;
D、金属D的活泼性强于金属铜,D是负极,Cu是正极,金属D表面反应为D失电子的氧化反应,故D错误.
故选B.
A-Cu连接时,电子从A→Cu,所以A的金属性大于铜;
B-Cu连接时,电子从Cu→B,所以铜的金属性大于B;
C-Cu连接时,电子从C→Cu,所以C的金属性大于铜;
D-Cu连接时,电子从D→Cu,所以D的金属性大于铜;
所以最不活泼的是B,其次是Cu,根据A、C、D的电压数据,知道压出越大,金属的活泼性差距越大,所以活泼性:C>A>D.,即金属的活泼性顺序是:C>A>D>Cu>B.
A、金属性由强到弱的顺序为:C>A>D>B,故A错误;
B、金属B的活泼性弱于铜,所以金属B不能从CuSO4溶液中置换出单质铜,故B正确;
C、放金属C时,金属C的活泼性强于Cu,所以C是负极,Cu是正极,正极铜片上发生得电子的还原反应O2+2H2O+4e-=4OH-,故C错误;
D、金属D的活泼性强于金属铜,D是负极,Cu是正极,金属D表面反应为D失电子的氧化反应,故D错误.
故选B.
点评:本题以原电池原理为载体考查了金属的金属性强弱比较,在原电池中可根据电子的流向、电极反应的反应类型、电极材料的变化等方法判断金属的金属性强弱,但不可根据电极的正负极判断金属的金属性强弱.

练习册系列答案
相关题目
纳米科技是21世纪经济发展的发动机.人们会利用纳米级(1~100nm,1nm=10-9 m)粒子物质制造出更加优秀的材料和器件,使化学在材料、能、环境和生命科学等领域发挥越越重要的作用.下列分散系中分散质颗粒与纳米级粒子在直径上具有相同数量级的是( )
| A、溶液 | B、悬浊液 |
| C、胶体 | D、乳浊液 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+ |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L |
| D、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-) |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题: 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.