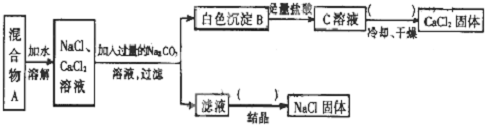
题目内容
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
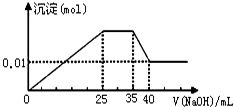
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
试回答下列问题:
(1)该溶液中一定不存在的阴离子有
(2)实验③中NaOH溶液滴至35mL后发生的离子方程式为
(3)通过实验和计算,填写下表中各阳离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 离子 | H+ | NH4+ | K+ | Mg2+ | Cu2+ | Al3+ |
| c/mol?L-1 |
(5)判断NO3-是否存在,若存在求其最小浓度,若不存在说明理由
(6)实验所加的NaOH溶液的浓度为
考点:常见离子的检验方法,离子方程式的有关计算
专题:
分析:根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+;
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
=0.03mol.
根据溶液中的电荷守恒以及离子的检验方法进行解答.
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
| 6.99g |
| 233g/mol |
根据溶液中的电荷守恒以及离子的检验方法进行解答.
解答:
解:根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+;
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
=0.03mol.
(1)通过以上分析知,溶液中一定不存在H+、Cu2+、CO32-,该溶液中一定不存在的阴离子有CO32-,故答案为:CO32-;
(2)实验③中NaOH溶液滴至35mL后,氢氧化铝开始溶解,发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2,n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)=
=0.1mol/L,生成0.01molMg(OH)2需要n(NaOH)是0.02mol,Al(OH)3和NaOH反应生成NaAlO2需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)=
=2.00mol/L,氢氧化铝和NaOH溶液反应生成NaAlO2时,结合原子守恒知,c(Al3+)=
=0.1mol/L,c(NH4+)=
=0.2mol/L,溶液中c(SO42-)=
=0.3mol/L,
根据溶液中电荷守恒知,3c(Al3+)+c(NH4+)+2(Mg2+)>2c(SO42-),所以溶液中还存在硝酸根离子,
故答案为:
;
(4)硝酸根离子存在,不能确定的是钾离子,可以进行焰色反应实验,用洁净的铂丝蘸取少量无色溶液,置于火焰上灼烧,透过蓝色钴玻璃,若观察到紫色火焰则证明存在K+,反之则无,故答案为:存在,用洁净的铂丝蘸取少量无色溶液,置于火焰上灼烧,透过蓝色钴玻璃,若观察到紫色火焰则证明存在K+,反之则无;
(5)根据溶液中电荷守恒知,3c(Al3+)+c(NH4+)+2(Mg2+)≥2c(SO42-)+c(NO3-),(若存在钾离子,则大于号成立,若无钾离子,则等号成立),最小浓度=3×0.1mol/L+0.2mol/L+2×0.1mol/L-2×0.3mol/L=0.1mol/L,故答案为:存在,其最小浓度为0.1mol/L;
(6)根据(3)的分析,c(NaOH)=
=2.00mol/L,故答案为:2.00 mol/L.
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
| 6.99g |
| 233g/mol |
(1)通过以上分析知,溶液中一定不存在H+、Cu2+、CO32-,该溶液中一定不存在的阴离子有CO32-,故答案为:CO32-;
(2)实验③中NaOH溶液滴至35mL后,氢氧化铝开始溶解,发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2,n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)=
| 0.01mol |
| 0.1L |
| 0.02mol |
| 0.01L |
| 2mol/L×0.005L |
| 0.1L |
| 2mol/L×0.01L |
| 0.1L |
| 0.03mol |
| 0.1L |
根据溶液中电荷守恒知,3c(Al3+)+c(NH4+)+2(Mg2+)>2c(SO42-),所以溶液中还存在硝酸根离子,
故答案为:
| 离子 | H+ | NH4+ | K+ | Mg2+ | Cu2+ | Al3+ |
| c/mol?L-1 | 0 | 0.2 | ? | 0.1 | 0 | 0.1 |
(4)硝酸根离子存在,不能确定的是钾离子,可以进行焰色反应实验,用洁净的铂丝蘸取少量无色溶液,置于火焰上灼烧,透过蓝色钴玻璃,若观察到紫色火焰则证明存在K+,反之则无,故答案为:存在,用洁净的铂丝蘸取少量无色溶液,置于火焰上灼烧,透过蓝色钴玻璃,若观察到紫色火焰则证明存在K+,反之则无;
(5)根据溶液中电荷守恒知,3c(Al3+)+c(NH4+)+2(Mg2+)≥2c(SO42-)+c(NO3-),(若存在钾离子,则大于号成立,若无钾离子,则等号成立),最小浓度=3×0.1mol/L+0.2mol/L+2×0.1mol/L-2×0.3mol/L=0.1mol/L,故答案为:存在,其最小浓度为0.1mol/L;
(6)根据(3)的分析,c(NaOH)=
| 0.02mol |
| 0.01L |
点评:本题考查了离子共存、离子反应的计算等知识点,定性分析离子共存、定量分析离子的物质的量是解本题的关键,题目难度大.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如表所示.已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )
| X | ||||
| Y | Z | W |
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
| B、Z的最高价氧化物的水化物酸性比W的强 |
| C、X的简单气态氢化物的稳定性比W的弱 |
| D、X分别与Y、Z形成的化合物中化学键类型相同 |
下列关于有机物的叙述正确的是( )
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸 |
| C、油脂和纤维素都是能发生水解反应的高分子化合物 |
| D、甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.