题目内容
 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.由于分子筛真有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用.某种型号的分子筛的工业生产 流程可简单表示如下:
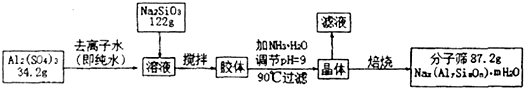
在加NH3?H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%.
(1)分子筛的孔道直径为4
| ? |
| A |
| ? |
| A |
| ? |
| A |
| ? |
| A |
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为
(4)加MH3?H2O调节pH后,加热到90℃并趁热过滤的原因可能是
(5)该生产流程中所得分子筛的化学式为
考点:物质分离和提纯的方法和基本操作综合应用,离子方程式的书写
专题:实验设计题
分析:(1)分离正丁烷和异丁烷,应选用分子筛的型号介于4.65A~5.6A之间;
(2)Al2(SO4)3溶液与Na2SiO3溶液反应发生双水解反应生成氢氧化铝沉淀和硅酸沉淀;
(3)由(3)可知钠原子的利用率为10%,且加入氨水,则滤液中一定含有硫酸钠和硫酸铵;
(4)加热能促进胶体聚沉,趁热过滤可以防止其他杂质结晶析出;
(5)计算n[Al2(SO4)3]、n(Na2SiO3),结合钠原子的利用率为10%,以及分子筛的质量计算水的质量,进而计算物质的量,可确定分子式;
(2)Al2(SO4)3溶液与Na2SiO3溶液反应发生双水解反应生成氢氧化铝沉淀和硅酸沉淀;
(3)由(3)可知钠原子的利用率为10%,且加入氨水,则滤液中一定含有硫酸钠和硫酸铵;
(4)加热能促进胶体聚沉,趁热过滤可以防止其他杂质结晶析出;
(5)计算n[Al2(SO4)3]、n(Na2SiO3),结合钠原子的利用率为10%,以及分子筛的质量计算水的质量,进而计算物质的量,可确定分子式;
解答:
(1)分离正丁烷和异丁烷,应选用分子筛的型号介于4.65A~5.6A之间,应选用5A型;
故答案为:5A;
(2)Al2(SO4)3溶液与Na2SiO3溶液反应发生双水解反应生成氢氧化铝沉淀和硅酸沉淀,反应的离子方程式为:2Al3++3SiO32-+6H2O=2Al(OH)3↓+3H2SiO3↓;
故答案为:2Al3++3SiO32-+6H2O=2Al(OH)3↓+3H2SiO3↓;
(3)由(3)可知钠原子的利用率为10%,且加入氨水,则滤液中一定含有硫酸钠和硫酸铵,生产流程中所得滤液里含有的离子除H+、OH-外含有:Na+、NH4+、SO42-;检验其中金属阳离子的操作方法是利用焰色反应检验,将铂丝放在酒精灯火焰上灼烧至无色,用铂丝蘸取溶液少许,在酒精灯火焰上灼烧,发出黄色火焰证明含有钠离子;
故答案为:Na+、NH4+、SO42-;将铂丝放在酒精灯火焰上灼烧至无色,用铂丝蘸取溶液少许,在酒精灯火焰上灼烧,发出黄色火焰证明含有钠离子;
(4)加MH3?H2O调节pH后,加热到90℃并趁热过滤的原因可能是加热能促进胶体聚沉,趁热过滤可以防止其他杂质结晶析出;
故答案为:加热能促进胶体聚沉,趁热过滤可以防止其他杂质结晶析出;
(5)n[Al2(SO4)3]=
=0.1mol,n(Na2SiO3)=
=1mol,
则n(Al2O3)=0.1mol,n(SiO2)=1mol,
因钠原子的利用率为10%,则n(Na2O)=1mol×10%=0.1mol,
又分子筛的质量为87.2g,
则n(H2O)=
=0.6mol,
则n(Na2O):n(Al2O3):n(SiO2):n(H2O)=0.1mol:0.1mol:1mol:0.6mol═1:1:10:6,
所以分子筛的化学式为Na2O?Al2O3?10SiO2?6H2O或Na2(Al2Si10O24)?6H2O,
故答案为:Na2O?Al2O3?10SiO2?6H2O或Na2(Al2Si10O24)?6H2O;
故答案为:5A;
(2)Al2(SO4)3溶液与Na2SiO3溶液反应发生双水解反应生成氢氧化铝沉淀和硅酸沉淀,反应的离子方程式为:2Al3++3SiO32-+6H2O=2Al(OH)3↓+3H2SiO3↓;
故答案为:2Al3++3SiO32-+6H2O=2Al(OH)3↓+3H2SiO3↓;
(3)由(3)可知钠原子的利用率为10%,且加入氨水,则滤液中一定含有硫酸钠和硫酸铵,生产流程中所得滤液里含有的离子除H+、OH-外含有:Na+、NH4+、SO42-;检验其中金属阳离子的操作方法是利用焰色反应检验,将铂丝放在酒精灯火焰上灼烧至无色,用铂丝蘸取溶液少许,在酒精灯火焰上灼烧,发出黄色火焰证明含有钠离子;
故答案为:Na+、NH4+、SO42-;将铂丝放在酒精灯火焰上灼烧至无色,用铂丝蘸取溶液少许,在酒精灯火焰上灼烧,发出黄色火焰证明含有钠离子;
(4)加MH3?H2O调节pH后,加热到90℃并趁热过滤的原因可能是加热能促进胶体聚沉,趁热过滤可以防止其他杂质结晶析出;
故答案为:加热能促进胶体聚沉,趁热过滤可以防止其他杂质结晶析出;
(5)n[Al2(SO4)3]=
| 34.2g |
| 3442g/mol |
| 122g |
| 122g/mol |
则n(Al2O3)=0.1mol,n(SiO2)=1mol,
因钠原子的利用率为10%,则n(Na2O)=1mol×10%=0.1mol,
又分子筛的质量为87.2g,
则n(H2O)=
| 87.2g-0.1mol×102g/mol-1mol×60g/mol-0.1mol×62g/mol |
| 18g/mol |
则n(Na2O):n(Al2O3):n(SiO2):n(H2O)=0.1mol:0.1mol:1mol:0.6mol═1:1:10:6,
所以分子筛的化学式为Na2O?Al2O3?10SiO2?6H2O或Na2(Al2Si10O24)?6H2O,
故答案为:Na2O?Al2O3?10SiO2?6H2O或Na2(Al2Si10O24)?6H2O;
点评:本题考查较为综合,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型和高频考点,注意把握题给信息,把握信息抽去能力的培养,从质量守恒的角度计算分子筛的化学式,难度中等.

练习册系列答案
相关题目
铍元素性质与铝元素性质相似,下列方法能证明氯化铍是分子晶体的是( )
| A、溶于硝酸银溶液,观察是否有白色沉淀生成 |
| B、溶于水做导电实验,观察是否导电 |
| C、熔融状态,做导电实验,观察是否导电 |
| D、测定氯化铍熔点 |
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B、HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
| C、HF、CH3CH2OH、NaOH都易溶于水,都是电解质 |
| D、HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
下列实验操作中正确的是( )


| A、用如图装置加热碳酸氢钠粉末 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、过滤时,若发现滤液浑浊,应更换滤纸,重新过滤 |
| D、制备Fe(OH)3胶体是向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题: 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.