题目内容
 如图是以石墨为电极电解CuCl2溶液的装置示意图.
如图是以石墨为电极电解CuCl2溶液的装置示意图.(1)电解过程中能量转化的主要形式是
(2)电解一段时间后,b电极上可观察到的现象是
(3)电解过程中,a电极为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知为电解装置,a为阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,b为阴极发生还原反应,电解方程式为Cu2++2e-=Cu,以此解答该题.
解答:
解:(1)电解时,电能转化为化学能,故答案为:电能转化为化学能;
(2)b为阴极发生还原反应,电解方程式为Cu2++2e-=Cu,可观察到析出红色固体,故答案为:析出红色固体;
(3)a为阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,检验氯气时,可将湿润的淀粉碘化钾试纸靠近a极,若试纸变蓝,说明有氯气生成,
故答案为:阳;2Cl--2e-=Cl2↑;将湿润的淀粉碘化钾试纸靠近a极,若试纸变蓝,说明有氯气生成.
(2)b为阴极发生还原反应,电解方程式为Cu2++2e-=Cu,可观察到析出红色固体,故答案为:析出红色固体;
(3)a为阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,检验氯气时,可将湿润的淀粉碘化钾试纸靠近a极,若试纸变蓝,说明有氯气生成,
故答案为:阳;2Cl--2e-=Cl2↑;将湿润的淀粉碘化钾试纸靠近a极,若试纸变蓝,说明有氯气生成.
点评:本题考查电解原理,明确电解原理及电极对电极反应的影响是解答本题的关键,题目难度不大,注重基础知识的考查.

练习册系列答案
相关题目
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、0.1 mol Fe与足量盐酸反应,转移的电子数为0.3NA |
| B、0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA |
| C、标况下,22.4L汽油的分子数为NA |
| D、常温常压下,36.5g HCl溶于水形成1L溶液,其物质的量浓度为1 mol?L-1 |
汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质产生的大气污染的方法是安装催化转换器,使它们发生反应生成CO2和N2.反应方程式为:2CO+2NO
2CO2+N2,其中NO是( )
| ||
| △ |
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
关于下列图示的说法中不正确的是( )


| A、用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图②所示实验装置排空气法收集H2气体 |
| C、图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 |
| D、图④两个装置中通过导线的电子数相同时,在正极上产生气体的物质的量也相同 |
下列热化学方程式或离子方程式中,正确的是( )
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 | ||||
B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||
| C、将过量二氧化硫气体入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O |
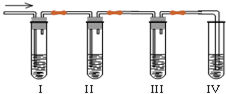 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题: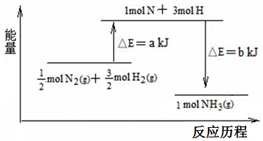 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.