题目内容
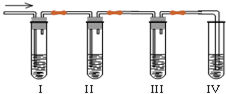 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是
(3)使用装置Ⅱ的目的是
(4)实验室由乙醇制乙烯的化学反应方程式为
考点:物质的检验和鉴别的实验方案设计
专题:实验设计题
分析:实验室里利用乙醇发生消去反应制取的乙烯中常混有少量的二氧化硫,I中盛放品红溶液,I中褪色可说明含二氧化硫;ⅡNaOH溶液可除去二氧化硫;Ⅲ品红溶液可检验二氧化硫除尽;Ⅳ中盛放酸性KMnO4溶液,溶液褪色可说明乙烯的存在,以此来解答.
解答:
解:实验室里利用乙醇发生消去反应制取的乙烯中常混有少量的二氧化硫,I中盛放品红溶液,I中褪色可说明含二氧化硫;ⅡNaOH溶液可除去二氧化硫;Ⅲ品红溶液可检验二氧化硫除尽;Ⅳ中盛放酸性KMnO4溶液,溶液褪色可说明乙烯的存在,
(1)由上述分析可知,I中试剂为A,IV中试剂为D,故答案为:A;D;
(2)说明二氧化硫气体存在的现象是装置I中品红溶液褪色,故答案为:装置I中品红溶液褪色;
(3)装置Ⅱ的目的是除去SO2气体,以免干扰乙烯的检验,故答案为:除去SO2气体,以免干扰乙烯的检验;
(4)实验室由乙醇制乙烯的化学反应方程式为CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O.
(1)由上述分析可知,I中试剂为A,IV中试剂为D,故答案为:A;D;
(2)说明二氧化硫气体存在的现象是装置I中品红溶液褪色,故答案为:装置I中品红溶液褪色;
(3)装置Ⅱ的目的是除去SO2气体,以免干扰乙烯的检验,故答案为:除去SO2气体,以免干扰乙烯的检验;
(4)实验室由乙醇制乙烯的化学反应方程式为CH3CH2OH
| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 170℃ |
点评:本题考查物质的制备实验及产物检验,为高频考点,把握物质的性质及实验中装置的作用为解答的关键,注意二氧化硫、乙烯均能被高锰酸钾氧化,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知 25℃时有关弱酸的电离平衡常数:
下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) |
| B、1 mol?L-1HCN溶液与1mol?L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
| C、1mol/L醋酸溶液加水稀释,所有离子浓度均减小 |
| D、等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) |
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:( )
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
| A、①② | B、②③ | C、①③ | D、②④ |
下列变化中,发生还原反应的是( )
| A、KCl→AgCl |
| B、CuSO4→Cu |
| C、CaCO3 →CO2 |
| D、H2→H2O |


 和
和 D、35Cl和37Cl E、乙醇和乙二醇
D、35Cl和37Cl E、乙醇和乙二醇 如图是以石墨为电极电解CuCl2溶液的装置示意图.
如图是以石墨为电极电解CuCl2溶液的装置示意图.