题目内容
下表列出了A-R九种元素在周期表中的位置,用元素符号或化学式填空.
(1)这九种元素中:化学性质最不活泼的是 ;金属性最强的是 ;最高价氧化物的水化物碱性最强的碱是 ;最高价氧化物的水化物酸性最强的酸是 .
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 .
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为 .
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是 .
(5)H元素跟A元素形成的化合物的化学式是 ;A2F2的电子式是 ;.
(6)B和F两种元素形成的2:1型化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 .
(7)国际无机化学命名委员会在1989年作出决定,把元素周期表的主、副族及其族号取消,由左至右改为1~18列.按这个规定,第15列元素应为 族元素,其简单氢化物的化学式为 (用字母“M”表示该族元素)
主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为
(4)F的氢化物的电子式
(5)H元素跟A元素形成的化合物的化学式是
(6)B和F两种元素形成的2:1型化合物属于
(7)国际无机化学命名委员会在1989年作出决定,把元素周期表的主、副族及其族号取消,由左至右改为1~18列.按这个规定,第15列元素应为
考点:位置结构性质的相互关系应用,元素周期表的结构及其应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表的位置可知,A、B、C、D、E、F、G、H、R分别为Na、K、Mg、Al、C、O、Cl、Br、Ar,
(1)以上几种元素,稀有气体的性质最不活泼,K的金属性最强,Cl的最高价氧化物的水化物酸性最强;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应,生成偏铝酸钠和水;
(3)电子层越多,半径越大,同周期原子序数大的半径小;
(4)F的氢化物为H2O,非金属性越强,气态氢化物越稳定;
(5)H元素跟A元素形成的化合物为离子化合物溴化钠,A2F2为Na2O2;
(6)B和F两种元素形成的2:1型化合物为K2O,为离子化合物;
(7)由左至右改为1~18列.按这个规定,第15列元素应为ⅤA族元素,最高价为+5价,其最低价为-3价.
(1)以上几种元素,稀有气体的性质最不活泼,K的金属性最强,Cl的最高价氧化物的水化物酸性最强;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应,生成偏铝酸钠和水;
(3)电子层越多,半径越大,同周期原子序数大的半径小;
(4)F的氢化物为H2O,非金属性越强,气态氢化物越稳定;
(5)H元素跟A元素形成的化合物为离子化合物溴化钠,A2F2为Na2O2;
(6)B和F两种元素形成的2:1型化合物为K2O,为离子化合物;
(7)由左至右改为1~18列.按这个规定,第15列元素应为ⅤA族元素,最高价为+5价,其最低价为-3价.
解答:
解:由元素在周期表的位置可知,A、B、C、D、E、F、G、H、R分别为Na、K、Mg、Al、C、O、Cl、Br、Ar,
(1)以上几种元素,Ar的性质最不活泼,K的金属性最强,最高价氧化物的水化物碱性最强的碱是KOH,最高价氧化物的水化物酸性最强的为HClO4,
故答案为:Ar;K;KOH;HClO4;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应,生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)电子层越多,半径越大,同周期原子序数大的半径小,原子半径由大到小的顺序排列为K>Na>Mg,故答案为:K>Na>Mg;
(4)F的氢化物为H2O,其电子式为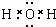 ,非金属性Cl>Br,气态氢化物稳定性为HCl>HBr,故答案为:
,非金属性Cl>Br,气态氢化物稳定性为HCl>HBr,故答案为: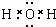 ;HCl>HBr;
;HCl>HBr;
(5)H元素跟A元素形成的化合物为离子化合物溴化钠,其化学式为NaBr,A2F2为Na2O2,其电子式为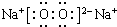 ,
,
故答案为:NaBr;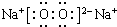 ;
;
(6)B和F两种元素形成的2:1型化合物为K2O,为离子化合物,其形成过程为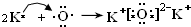 ,
,
故答案为:离子化合物;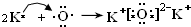 ;
;
(7)由左至右改为1~18列.按这个规定,第15列元素应为ⅤA族元素,最高价为+5价,其最低价为-3价,其氢化物可表示为MH3,故答案为:ⅤA;MH3.
(1)以上几种元素,Ar的性质最不活泼,K的金属性最强,最高价氧化物的水化物碱性最强的碱是KOH,最高价氧化物的水化物酸性最强的为HClO4,
故答案为:Ar;K;KOH;HClO4;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应,生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)电子层越多,半径越大,同周期原子序数大的半径小,原子半径由大到小的顺序排列为K>Na>Mg,故答案为:K>Na>Mg;
(4)F的氢化物为H2O,其电子式为
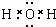 ,非金属性Cl>Br,气态氢化物稳定性为HCl>HBr,故答案为:
,非金属性Cl>Br,气态氢化物稳定性为HCl>HBr,故答案为: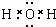 ;HCl>HBr;
;HCl>HBr;(5)H元素跟A元素形成的化合物为离子化合物溴化钠,其化学式为NaBr,A2F2为Na2O2,其电子式为
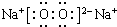 ,
,故答案为:NaBr;
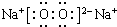 ;
;(6)B和F两种元素形成的2:1型化合物为K2O,为离子化合物,其形成过程为
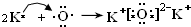 ,
,故答案为:离子化合物;
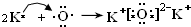 ;
;(7)由左至右改为1~18列.按这个规定,第15列元素应为ⅤA族元素,最高价为+5价,其最低价为-3价,其氢化物可表示为MH3,故答案为:ⅤA;MH3.
点评:本题考查位置、结构、性质的关系及应用,为高频考点,把握元素的位置及性质为解答的关键,侧重考查元素化合物性质及化学用语,注重基础知识的夯实,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,水蒸气的物质的量增加了4.5mol,则此反应的平均速率
(X)(反应物的消耗速率或产物的生成速率)可表示为( )
. |
| v |
| A、v(NH3)=0.01mol/(L?s) |
| B、v(O2)=0.03mol/(L?s) |
| C、v(NO)=0.02mol/(L?s) |
| D、v(H2O)=0.04mol/(L?s) |
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:( )
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
①降温 ②把镁条粉碎 ③加入蒸馏水使盐酸变稀 ④升温.
| A、①② | B、②③ | C、①③ | D、②④ |
某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g)?2HI(g).下列情
况能说明该反应一定达到平衡的是( )
况能说明该反应一定达到平衡的是( )
| A、混合气体的颜色不再改变的状态 |
| B、混合气体的压强不再改变的状态 |
| C、单位时间内拆开1mol H-H键,同时拆开1mol H-I键 |
| D、混合气体的密度不再改变的状态 |
某些物质发生化学反应时,化学能可以转化为电能,这类化学反应是( )
| A、非氧化还原反应 |
| B、氧化还原反应 |
| C、放热反应 |
| D、吸热反应 |
 和
和 D、35Cl和37Cl E、乙醇和乙二醇
D、35Cl和37Cl E、乙醇和乙二醇 如图是以石墨为电极电解CuCl2溶液的装置示意图.
如图是以石墨为电极电解CuCl2溶液的装置示意图.