题目内容
6.已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C3的浓度为wmol/L,放出热量bkJ.(1)比较a>b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数.
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d>b(填>、=、<).
(5)在一定温度下,向一个容积不变的容器中,通入3molA2 和2molB2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4molA2、3molB2、2molC3,则平衡时A2的转化率变大(填“不变”、“变大”、“变小”或“不能确定”)
(6)碳酸锶广泛应用于电子工业.以天青石(主要成分为SrSO4)为基本原料制备碳酸锶.(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10.)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为:SrSO4+CO32-═SrCO3+SO42-.
②当转化完成时,混合液中c(CO32-)=1.0×10-3mol/L,c(SO42-)=2.91mol/L.
分析 (1)根据可逆反应没有完全进行,即释放的热量小于完全反应释放的热量分析;
(2)两个反应为等效平衡,达到平衡时各组分的物质的量浓度相等;相同条件下,2molC3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC3,放出热量为c kJ,据此判断;
(3)为使该反应的反应速率增大,且平衡向正反应方向移动,依据影响化学反应速率和化学平衡的因素分析判断;
(4)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大;
(5)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强;
(6)①根据Ksp(SrCO3)小于Ksp(SrSO4),则天青石矿粉与Na2CO3溶液搅拌混匀、加热发生反应生成SrCO3和硫酸钠;
②当转化完成时,根据Ksp(SrCO3)计算c(Sr2+),再根据Ksp(SrSO4)计算c(SO42-).
解答 解:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而加入2mol A2和1mol B2达到平衡时,可逆反应没有完全进行,即释放的热量小于完全反应释放的热量,即b<a,
故答案为:>;
(2)相同条件下,2molC3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,所以C3的浓度等于wmol•L-1;即从化学平衡状态到完全反应生成2molC3,放出热量为c kJ,则:b+c=a,故答案为:=;a=b+c;
(3)已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),反应是气体体积减小的放热反应,依据平衡移动原理分析,反应的反应速率增大,且平衡向正反应方向移动;
A.及时分离出C3气体,反应正向进行,但反应速率减小,故A不符合;
B.适当升高温度,加快反应速率,但平衡逆向进行,故B不符合;
C.增大B2的浓度,平衡正向进行,反应速率增大,故C符合;
D.选择高效催化剂,增大反应速率,但不改变平衡,故D不符合;
故答案为:C;
(4)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大,生成C3比恒容时多,则放出的热量也多,故d>b,
故答案为:>;
(5)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强,平衡正向移动,则平衡时A2的转化率变大,
故答案为:变大;
(6)①由Ksp(SrCO3)小于Ksp(SrSO4),则天青石矿粉与Na2CO3溶液搅拌混匀、加热发生反应生成SrCO3和硫酸钠,离子方程式为:SrSO4+CO32-═SrCO3+SO42-;故答案为:SrSO4+CO32-═SrCO3+SO42-;
②Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10,当转化完成时,混合液中c(CO32-)=1.0×10-3mol/L,
所以c(Sr2+)=$\frac{1.1×10{\;}^{-10}}{1.0×10{\;}^{-3}}$=1.1×10-7mol/L,c(SO42-)=$\frac{3.2×10{\;}^{-7}}{1.1×10{\;}^{-7}}$=2.91mol/L,
故答案为:2.91mol/L.
点评 本题考查较为综合,涉及等效平衡、影响平衡的因素、Ksp的计算等知识,难度中等,侧重于考查学生对基础知识的应用能力.

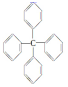 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 此分子中有极性键和非极性键 | D. | 此物质属芳香烃类物质 |
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |

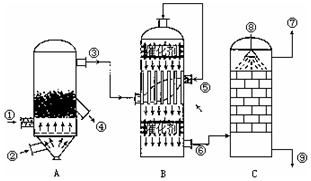
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.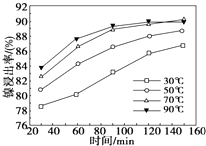 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题: