题目内容
7.某溶液pH=1,该溶液中可能含有Fe3+、NO3-、I-、Cl-中的一种或几种,向该溶液中滴入溴水,单质溴被还原,由此推断该溶液中( )| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
分析 向该溶液中滴入溴水,单质溴被还原,可知溶液中一定含I-,且溶液pH=1,溶液显酸性,以此来解答.
解答 解:向该溶液中滴入溴水,单质溴被还原,可知溶液中一定含I-,则一定不含Fe3+,二者可发生氧化还原反应不能共存;
且溶液pH=1,溶液显酸性,I-、H+、NO3-发生氧化还原反应不能共存,则不能存在NO3-,
不能确定是否含Cl-,
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.有下有机物,请将它所对应的类别用序号填入下列表格中:
(1)CH3CH2CH3 ①酯
(2)CH2=CH-CH3 ②羧酸
(3)CH3COOCH3 ③醛
(4)CH3-CHO ④醇
(5)CH3-OH ⑤烯烃
(6)CH3CH2COOH ⑥烷烃
(1)CH3CH2CH3 ①酯
(2)CH2=CH-CH3 ②羧酸
(3)CH3COOCH3 ③醛
(4)CH3-CHO ④醇
(5)CH3-OH ⑤烯烃
(6)CH3CH2COOH ⑥烷烃
| 物质编号 | 所属类别编号 | 物质编号 | 所属类别编号 |
| (1) | (4) | ||
| (2) | (5) | ||
| (3) | (6) |
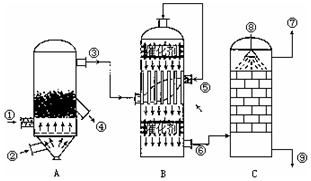
19.零价铁(Fe)除去水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图所示.的反应原理如图1所示.
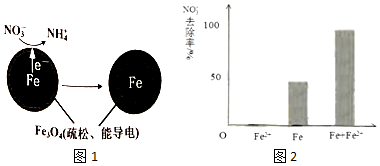
正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
pH=4.5时,NO3-的去除率低.其原因是因为铁表面生成不导电的FeO(OH),将铁全部覆盖,阻止反应进一步发生.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.pH=4.5(其他条件相同)
Ⅱ.高铁酸钠Na2FeO4
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式为.
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式.
(1)Fe还原水体中NO3-的反应原理如图所示.的反应原理如图1所示.

正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.pH=4.5(其他条件相同)
Ⅱ.高铁酸钠Na2FeO4
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式为.
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式.
16.下列物质中最简式相同,但既不是同系物,也不是同分异构体,又不含相同官能团的是( )
| A. | CH3CH=CH2和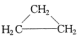 | B. | 乙炔和苯 | C. |  和 和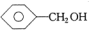 | D. | 乙酸和甲酸甲酯 |
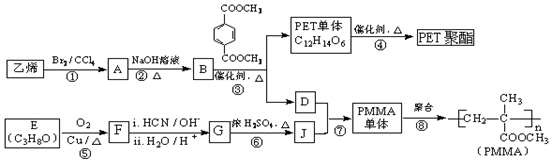
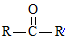 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$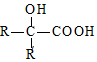 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. 金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).
金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况). CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.
CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol. +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$