题目内容
17.铜及其化合物在工农业生产及日常生活中应用非常广泛.回答下列问题:(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.
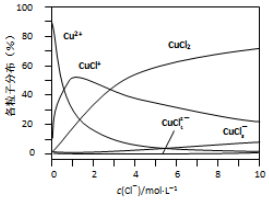
①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.
分析 (1)①用炭粉在高温条件下还原CuO生成Cu2O和CO2反应的方程式为:C+4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+CO2,还原剂是碳,氧化剂是氧化铜,还原剂与氧化剂的物质的量之比为1:4;
②肼还原新制Cu(0H)2可制备纳米级Cu2O,同时放出N2,结合质量守恒书写方程式;
(2)从价态变化出发分析得失电子总数解答;
(3)①从图上在c(Cl-)=9mol•L-1处,做一条平行与纵轴的虚线,可以比较;
②从图上在c(Cl-)=1mol•L-1处,做一条平行与纵轴的虚线,看哪种微粒最多;
(4)铜离子水解生成氢氧化铜和氢离子,依据沉淀溶度积常数和溶液中离子积常数计算.
解答 解:(1)①用炭粉在高温条件下还原CuO生成Cu2O和CO2反应的方程式为:C+4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+CO2,还原剂是碳,氧化剂是氧化铜,还原剂与氧化剂的物质的量之比为1:4,故答案为:1:4;
②肼还原新制Cu(0H)2可制备纳米级Cu2O,同时放出N2,则反应的方程式为N2H4+4Cu(OH)2═2Cu2O+N2+6H2O,故答案为:4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O;
(2)从反应4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4分析,Cu从+2价变成+1,4molCu得到4mol电子,H从+1价变成-1价,4mol-1价的H得到8mol电子,共得电子12mol,P从+1价变成+5价,3molP共失电子12mol,每生成4molCuH转移电子12mol,所以,转移电子3mol时应生成CuH1mol,
故答案为:1mol;
(3)①在c(Cl-)=9mol•L-1处,做一条平行与纵轴的虚线,可见溶液中主要含铜物种浓度大小关系为:c(CuCl2)>c(CuCl+)>c(CuCl3-)>c(Cu2+)>c(CuCl42-),
故答案为:c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1mol•L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,加入硝酸银,氯离子浓度下降,方程式为:CuCl++Ag+=Cu2++AgCl↓,故答案为:CuCl++Ag+=Cu2++AgCl↓;
(4)铜离子水解离子反应为Cu2++2H2O?Cu(OH)2+2H+,Ksp=c(Cu2+)×c2(OH-)=2.0×10-20mol3•L-3,则K=$\frac{{c}^{2}({H}^{+})}{c(C{u}^{2+})}$=$\frac{{c}^{2}({H}^{+})×{c}^{2}(O{H}^{-})}{c(C{u}^{2+})×{c}^{2}(O{H}^{-})}$=$\frac{{K}_{w}^{2}}{{K}_{sp}}$=$\frac{(1{0}^{-14})^{2}}{2.0×1{0}^{-20}}$=5×10-9,故答案为:5×10-9.
点评 本题考查氧化还原反应的计算、离子积、化学方程式的书写、图象分析等,侧重考查学生对数据的分析处理能力,难度中等.

| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其结构式为
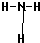 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.(3)现有另一种元素X,其原子获得一个电子所释放出的能量是所有短周期元素中最大的,则X元素在周期表中的位置是第2周期第VIIA族.
(4)“神舟”载人飞船内需要有一种由上表提供的某两种元素组成的化合物来吸收航天员呼出的CO2并放出O2,该物质的电子式为
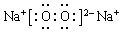 .
. | A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 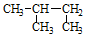 2-甲基丁烷 2-甲基丁烷 |
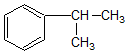
| A. | 它不能使溴水褪色也不能使酸性KMnO4溶液褪色 | |
| B. | 在FeBr3作催化剂时与Br2发生取代反应 | |
| C. | 在一定条件下可发生加成反应 | |
| D. | 一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |

 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.