题目内容
14.与100mL 0.5mol•L-1NaCl溶液中的Cl-的物质的量浓度相同的是( )| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
分析 100ml 0.5mol/L NaCl中Cl-物质的量浓度为0.5mol/L,结合离子浓度=溶质浓度×离子数计算比较,微粒浓度和溶液体积无关.
解答 解:100ml 0.5mol/L NaCl中Cl-物质的量浓度为0.5mol/L,
A.100ml 0.5 mol/L MgCl2 溶液中氯离子的物质的量浓度为0.5 mol/L×2=1mol/L,故A错误;
B.100mL 0.5mol•L-1KClO3溶液中无氯离子,故B错误;
C.200ml 0.25 mol/L KCl溶液中氯离子的物质的量浓度0.25 mol/L×1=0.25mol/L,故C错误;
D.100ml 0.5mol/L HCl溶液中氯离子的物质的量浓度为0.5mol/L,故D正确.
故选D.
点评 本题考查物质的量浓度的相关计算,为高频考点,注意“溶液中离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算,与溶液的体积无关”,难度不大.

练习册系列答案
相关题目
5.下列关于铜电极的叙述中不正确的是( )
| A. | 用电解法精炼粗铜时,粗铜作阳极 | |
| B. | 在原电池中,铜电极只能作正极 | |
| C. | 在镀件上镀铜时,金属铜作阳极 | |
| D. | 锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应 |
2.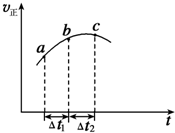 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,
由图可得出的不正确结论是( )
 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,
由图可得出的不正确结论是( )
| A. | 反应在C点达到平衡状态 | |
| B. | 反应物的总能量大于生成物的总能量 | |
| C. | 反应物浓度:a点大于b点 | |
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
9.某化学反应过程如图所示,由图得出的判断,正确的是( )
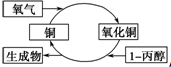

| A. | 反应中有红黑颜色交替变化的现象 | B. | 1-丙醇发生了还原反应 | ||
| C. | 生成物是丙醛和丙酮 | D. | 醇类都能发生图示的催化氧化反应 |
19.下列实验操作或装置正确的是( )
| A. |  稀释浓硫酸 | B. |  排水集气法收集NO | ||
| C. |  分离水与 酒精 | D. |  干燥氨气 |
6.在酸性溶液中,下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A. | Na+、K+、SO42-、Cl- | B. | Na+、ClO-、SO42-、Fe2+ | ||
| C. | Ba2+、K+、HCO3-、NO3- | D. | Ba2+、Na+、SO42-、SO32- |
3.今有一混合物的水溶液,含有以下离子中的若干种:Na+、CO32-、Cl-、Ba2+、NH4+、SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL(提示:NH4++OH-=NH3↑+H2O)
(3)第三份加足量Ba(NO3)2溶液,得沉淀4.30g,再用足量硝酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测不正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL(提示:NH4++OH-=NH3↑+H2O)
(3)第三份加足量Ba(NO3)2溶液,得沉淀4.30g,再用足量硝酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测不正确的是( )
| A. | 该溶液中.Na+一定存在,且浓度为0.1mol/L | |
| B. | 该溶液中CO32-和SO42-一定存在,且物质的量浓度均为0.1mol/L | |
| C. | Ba2+一定不存在 | |
| D. | NH4+ 一定存在,且100mL溶液中物质的量为0.02mol |