题目内容
19.下列实验操作或装置正确的是( )| A. |  稀释浓硫酸 | B. |  排水集气法收集NO | ||
| C. |  分离水与 酒精 | D. |  干燥氨气 |
分析 A.量筒不能用来稀释溶液;
B.NO不溶于水;
C.水和酒精不分层;
D.氨气能与浓硫酸反应生成硫酸铵.
解答 解:A.量筒不能用来稀释溶液,应在小烧杯中进行,故A错误;
B.NO不溶于水,可用排水法收集,故B正确;
C.水和酒精不分层,无法用分液分离,故C错误;
D.氨气能与浓硫酸反应生成硫酸铵,应用碱石灰干燥,故D错误.
故选B.
点评 本题考查较为综合,涉及溶液配制、物质的分离和气体干燥,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列关于各图象的解释或结论不正确的是( )
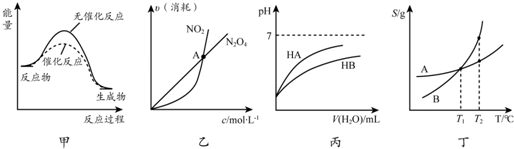

| A. | 由甲可知:使用催化剂不影响反应热 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 | |
| D. | 由丁可知:将T1℃的A、B饱和溶液升温至T2℃时,A与B溶液的质量分数相等 |
7.下列检验离子的方法及结论正确的是( )
| A. | 向某溶液中滴加AgNO3溶液后产生白色沉淀,说明原溶液中含有Cl- | |
| B. | 向某溶液中滴加BaCl2溶液后产生白色沉淀,说明原溶液中含有SO42- | |
| C. | 向某溶液中滴加NaOH溶液并加热,产生气体能使红色石蕊试纸变蓝,说明原溶液中含有NH4+ | |
| D. | 向某溶液中滴加稀硫酸后生成无色无味气体,说明原溶液中含有CO32- |
14.与100mL 0.5mol•L-1NaCl溶液中的Cl-的物质的量浓度相同的是( )
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
4.下列有关化学用语表述正确的是( )
| A. | 质子数为8的氧原子: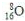 | |
| B. | 漂白粉的有效成分:NaClO | |
| C. | Mg2+结构示意图: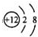 | |
| D. | 钠在氧气中燃烧的化学方程式:4Na+O2 $\frac{\underline{\;点燃\;}}{\;}$2Na2O |
11.下列说法正确的是( )
| A. | 仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 教材中用纸层析法分离Fe3+和Cu2+实验,滤纸上吸附的丙酮作为固定相,水作为流动相 |
8.我国高速铁路技术世界领先.高速铁路的无缝钢轨是将钢轨间的接头用铝与氧化铁发生铝热反应进行焊接而成的.对于铝热反应:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3,下列说法中正确的是( )
| A. | Fe元素的化合价升高 | B. | Al被还原 | ||
| C. | Fe2O3发生还原反应 | D. | Al是还原剂 |
9.有甲、乙两醋酸稀溶液,测得甲的PH=2,乙的PH=3,下列推断中正确的是( )
| A. | 物质的量浓度C(甲)=C(乙) | |
| B. | 甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 | |
| C. | 中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲) | |
| D. | 甲中的C(OH-)为乙中C(OH-)的10倍 |