题目内容
9.某化学反应过程如图所示,由图得出的判断,正确的是( )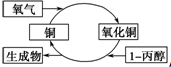
| A. | 反应中有红黑颜色交替变化的现象 | B. | 1-丙醇发生了还原反应 | ||
| C. | 生成物是丙醛和丙酮 | D. | 醇类都能发生图示的催化氧化反应 |
分析 图示中发生的化学反应可以表述为2Cu+O2═2CuO,CuO+CH3CH2CH2OH-→CH3CH2CHO+Cu+H2O,总反应为醇的催化氧化,据此分析解答.
解答 解:图示中发生的化学反应可以表述为2Cu+O2═2CuO,现象为铜丝变黑,CuO+CH3CH2CH2OH-→CH3CH2CHO+Cu+H2O,现象为黑色的铜丝又变红色,总反应为醇的催化氧化,1-丙醇发生了氧化反应,产物为丙醛,催化剂为铜,只有A正确;
故选:A.
点评 本题考查醇类的催化氧化反应,明确醇催化氧化的原理是解题关键,注意醇氧化条件和产物的判断,题目难度不大.

练习册系列答案
相关题目
19.以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )
| A. | Mg片作负极,电极反应:Mg-2e-═Mg2+ | |
| B. | Al片作负极,电极反应:Al+4OH--3e-═AlO2-+2H2O | |
| C. | 电子从Mg电极沿导线流向Al电极 | |
| D. | Al片上有气泡产生 |
20.已知反应4CO+2NO2?N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A. | v(CO)=0.03 mol/(L•s) | B. | v(NO2)=0.7 mol/(L•min) | ||
| C. | v(N2)=0.4 mol/(L•min) | D. | v(CO2)=1.1 mol/(L•min) |
17.下列各种溶液中,可能大量共存的离子组是( )
| A. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:Na+、AlO${\;}_{2}^{-}$、S2-、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Fe3+的溶液中:Na+、SCN-、K+、NO${\;}_{3}^{-}$ | |
| D. | c(H+)=10-14 mol•L-1的溶液中:Mg2+、NO${\;}_{3}^{-}$、Fe2+、ClO- |
4.25℃,某溶液中水电离出的c(H+)=10-5mol/L,则该溶液可能是下列情况中的( )
| A. | 该溶液是盐溶液 | |
| B. | 该溶液可能是酸或碱溶 | |
| C. | 该溶液中c(OH-)=10-5mol/L | |
| D. | 该溶液与pH=9的氢氧化钠等体积混合,混合后溶液可能呈中性 |
14.与100mL 0.5mol•L-1NaCl溶液中的Cl-的物质的量浓度相同的是( )
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
18.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,22.4 L乙烯中C-H键数为4NA | |
| B. | 1 mol甲醇中含有C-H键的数目为4NA | |
| C. | 1mol金刚石晶体中C-C键数目2NA | |
| D. | 1molSiO2晶体Si-O键数目2NA |
19.化学知识可以帮助理解和解决日常生活中遇到的许多问题,下列说法错误的是( )
| A. | 胃酸过多的病人,可以服用氢氧化钠来中和胃酸 | |
| B. | 晶体硅是在通信工程中制作光导纤维的主要原料 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存 | |
| D. | 二氧化硅与氢氟酸的反应原理可用来雕刻玻璃 |