题目内容
5.下列关于铜电极的叙述中不正确的是( )| A. | 用电解法精炼粗铜时,粗铜作阳极 | |
| B. | 在原电池中,铜电极只能作正极 | |
| C. | 在镀件上镀铜时,金属铜作阳极 | |
| D. | 锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应 |
分析 A.粗铜不纯,作电解池的阳极正极溶解;
B.活泼性强的金属失电子作负极;
C.电镀时镀层金属作阳极;
D.正极上溶液中的阳离子得电子.
解答 解:A.粗铜不纯,作电解池的阳极可除去杂质金属,在阴极上析出纯铜,故A正确;
B.Cu与Ag、硝酸银溶液构成原电池时,Cu的活泼性大于Ag,Cu失电子作负极,故B错误;
C.在镀件上镀铜时,镀层金属作阳极,即金属铜作阳极,故C正确;
D.铜为不活泼金属,在锌铜原电池中铜是正极,正极上是溶液中的氢离子得电子发生还原反应,故D正确.
故选B.
点评 本题考查铜电极知识,题目涉及原电池和电解池原理,题目难度不大,注意铜的活泼性以及电镀和铜的精炼的原理.

练习册系列答案
相关题目
20.已知反应4CO+2NO2?N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A. | v(CO)=0.03 mol/(L•s) | B. | v(NO2)=0.7 mol/(L•min) | ||
| C. | v(N2)=0.4 mol/(L•min) | D. | v(CO2)=1.1 mol/(L•min) |
17.下列各种溶液中,可能大量共存的离子组是( )
| A. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:Na+、AlO${\;}_{2}^{-}$、S2-、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Fe3+的溶液中:Na+、SCN-、K+、NO${\;}_{3}^{-}$ | |
| D. | c(H+)=10-14 mol•L-1的溶液中:Mg2+、NO${\;}_{3}^{-}$、Fe2+、ClO- |
14.与100mL 0.5mol•L-1NaCl溶液中的Cl-的物质的量浓度相同的是( )
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
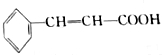 也存在反式结构,1mol
也存在反式结构,1mol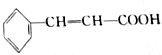 最多可以与4molH2发生加成反应.
最多可以与4molH2发生加成反应.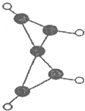 (1)某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件组合是①②④.(填相应的数字序号)
(1)某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件组合是①②④.(填相应的数字序号)