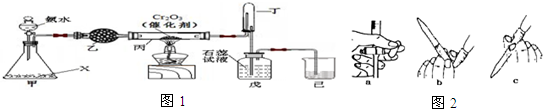
题目内容
2.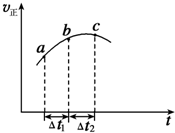 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,
由图可得出的不正确结论是( )
| A. | 反应在C点达到平衡状态 | |
| B. | 反应物的总能量大于生成物的总能量 | |
| C. | 反应物浓度:a点大于b点 | |
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
分析 由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快.
解答 解:A.化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,故A错误;
B.从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故B正确;
C.a到b时正反应速率增加,反应物浓度随时间不断减小,故C正确;
D.随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,SO2的转化率将逐渐增大,故D正确;
故选A.
点评 本题考查化学反应速率和平衡图象,注意该反应的特点及反应限制条件,一定要读懂,“绝热恒容密闭容器”这句话表达的含义,难度较大.

练习册系列答案
相关题目
17.下列各种溶液中,可能大量共存的离子组是( )
| A. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:Na+、AlO${\;}_{2}^{-}$、S2-、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Fe3+的溶液中:Na+、SCN-、K+、NO${\;}_{3}^{-}$ | |
| D. | c(H+)=10-14 mol•L-1的溶液中:Mg2+、NO${\;}_{3}^{-}$、Fe2+、ClO- |
7.下列检验离子的方法及结论正确的是( )
| A. | 向某溶液中滴加AgNO3溶液后产生白色沉淀,说明原溶液中含有Cl- | |
| B. | 向某溶液中滴加BaCl2溶液后产生白色沉淀,说明原溶液中含有SO42- | |
| C. | 向某溶液中滴加NaOH溶液并加热,产生气体能使红色石蕊试纸变蓝,说明原溶液中含有NH4+ | |
| D. | 向某溶液中滴加稀硫酸后生成无色无味气体,说明原溶液中含有CO32- |
14.与100mL 0.5mol•L-1NaCl溶液中的Cl-的物质的量浓度相同的是( )
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
11.下列说法正确的是( )
| A. | 仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 教材中用纸层析法分离Fe3+和Cu2+实验,滤纸上吸附的丙酮作为固定相,水作为流动相 |
12.下列关于说法不正确的是( )
| A. | 二氧化硫能使浸过酸性高锰酸钾溶液的滤纸褪色说明二氧化硫具有漂白性 | |
| B. | 将收集满二氧化氮气体的试管倒立在水中,水会充满试管 | |
| C. | 氨气可以做喷泉实验,这是利用氨气极易溶于水的性质 | |
| D. | 在实验室中,不能利用稀硝酸与锌粒反应制氢气 |