题目内容
7.将等物质的量Fe2O3与FeCl3置于密闭管中加热,能恰好完全反应,且只生成一种产物X,其物质的量是反应物总物质的量的1.5倍,写出X的化学式FeOCl.分析 依据反应前后原子守恒分析判断X的化学式,据此进行分析.
解答 解:将等物质的量Fe2O3与FeCl3置于密闭管中加热,能恰好完全反应,且只生成一种产物X,其物质的量是反应物总物质的量的1.5倍,设Fe2O3与FeCl3物质的量都是1mol,生成X物质的量为3mol,Fe2O3+FeCl3=3X,则依据原子守恒得到:X为FeOCl,
故答案为:FeOCl.
点评 本题考查了物质推断方法,原子守恒的分析应用,注意题干条件和信息的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
3. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 工业上用Y和Z组成的化合物冶炼Z的单质 | |
| C. | X、Y形成的化合物一定为酸性氧化物 | |
| D. | W的单质和氧化物均可与NaOH溶液反应 |
4.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 200g 63%的浓硝酸中含氧原子的数目为6NA | |
| B. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0kJ/mol,乙稀与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间的共用电子对数目为NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
15.下列离子组能大量共存的是( )
| A. | Fe3+、K+、OH-、Cl- | B. | Na+、Zn2+、CO32-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
12.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 乙醛和丙烯醛( )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| B. | 一分子β-月桂烯( )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 | |
| C. | 用甘氨酸( )和丙氨酸( )和丙氨酸( )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 | |
| D. |  和 和  都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 |
19.下列有关Na2O2的叙述正确的是( )
| A. | Na2O2中阴、阳离子个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量O2时,需水和CO2的质量相等 | |
| C. | Na2O2与SO2的漂白原理相同 | |
| D. | 与H2O、CO2反应产生等量O2时,消耗等量的Na2O2 |
16.在一个容积固定的反应容器中有一可左右滑动的密封隔板,将反应容器分甲、乙两室,甲室充入的是氢气与氯气,共2mol,乙室充入的是一氧化碳与氧气也共2mol,在一定条件下充分反应恢复到起始状态,反应前后变化如图所示:则起始时乙中一氧化碳与氧气的体积比可能为( )
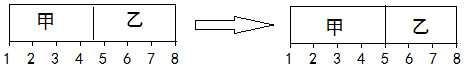

| A. | 1:2 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
17.某短周期元素原子的最外电子层只有2个电子,该元素可能是( )
| A. | VIIA族元素 | B. | VIA族元素 | C. | 第三周期元素 | D. | IA族元素 |

 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O
+NaBr+H2O