题目内容
6.下列说法中正确的是( )| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
分析 A.镁原子的3s能级处于全满稳定状态,能量较低,第一电离能比Al元素高;
B.同主族自上而下第一电离能降低,同周期自左而右第一电离能增大;
C.同周期主族元素从左到右作用到电离能逐渐增大,到稀有气体由于具有稳定的电子层结构,其电离能最大;
D.同周期自左而右,元素的第一电离能增大,注意能级处于半满、全满的稳定特殊情况.
解答 解:A.镁原子的3s能级处于全满稳定状态,能量较低,第一电离能比Al元素高,故A错误;
B.同主族自上而下第一电离能降低,故第一电离能Na>K,同周期自左而右第一电离能增大,故第一电离能Mg>Na,所以第一电离能Mg>K,故B错误;
C.同周期主族元素从左到右作用到电离能逐渐增大,同族元素从上到下第一电离能逐渐减小,则氦的第一电离能最大,故C错误;
D.同周期自左而右,元素的第一电离能增大,故第3周期所包含的元素中钠的第一电离能最小,故D正确;
故选D.
点评 本题考查第一电离能的变化规律等,比较基础,注意同周期主族元素能级处于半满、全满的稳定特殊情况第一电离能增大的特殊情况,题目难度不大.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
17.下列实验装置能达到目的是( )
| 选项 | A | B | C | D |
| 装置 |  |  |  |  |
| 目的 | 快速制取少量HCl气体 | 测定不同浓度的H2O2溶液对产生O2速率的影响 | 制备并收集乙酸乙酯 | 从小苏打溶液中提取NaHCO3晶体 |
| A. | A | B. | B | C. | C | D. | D |
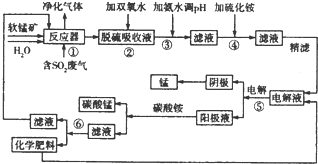
14.采用软锰矿浆(主要成分为Mn02,还含有Fe2O3、FeO、NiO、CoO等杂质)对工业烟气脱硫是工业生产中的一项新技术,该技术在脱硫的过程中还可以生产金属锰及化学肥料.该工艺流程如下图:
部分金属离子沉淀时的PH如下表:
回答下列问题:
(1)步骤①的反应器为“喷射鼓泡反应器,即将高速废气流通入到一定液固比的软锰矿浆中,并不断搅拌,采用这种设备的好处是增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率,该反应的还原产物为亚铁离子、锰离子.
(2)写出步骤②中反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
(3)若步骤③调节pH使用的是NaOH溶液,则导致的后果是后续得到有化学肥料中含有硫酸钠杂质.
(4)步骤④加入(NH4)2S的目的是除去溶液中的Ni2+、Co2+,加入(NH4)2S时溶液的pH最好控制在6.0以下,原因是防止锰离子生成硫化锰沉淀.
(5)步骤⑤所用设备名称为电解槽.
(6)步骤⑥的化学肥料为硫酸铵,该肥料加入到步骤⑤中的作用是增加溶液的导电性.

部分金属离子沉淀时的PH如下表:
| 阳离子 | Fe2+ | Fe3+ | Mn2+ | Ni2+ | Co2+ | |
| 氢氧化物沉淀 | 开始沉淀的PH | 7.5 | 2.2 | 8.8 | 6.4 | 9.0 |
| 完全沉淀的PH | 9.5 | 3.5 | 10.8 | 8.4 | ||
| 硫化物沉淀 | 开始沉淀的PH | 6.2 | 4.67 | |||
| 完全沉淀的PH | ||||||
(1)步骤①的反应器为“喷射鼓泡反应器,即将高速废气流通入到一定液固比的软锰矿浆中,并不断搅拌,采用这种设备的好处是增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率,该反应的还原产物为亚铁离子、锰离子.
(2)写出步骤②中反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
(3)若步骤③调节pH使用的是NaOH溶液,则导致的后果是后续得到有化学肥料中含有硫酸钠杂质.
(4)步骤④加入(NH4)2S的目的是除去溶液中的Ni2+、Co2+,加入(NH4)2S时溶液的pH最好控制在6.0以下,原因是防止锰离子生成硫化锰沉淀.
(5)步骤⑤所用设备名称为电解槽.
(6)步骤⑥的化学肥料为硫酸铵,该肥料加入到步骤⑤中的作用是增加溶液的导电性.
1. 某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处
某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处
SO42-从右向左移动.下列分析正确的是( )
 某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处
某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处SO42-从右向左移动.下列分析正确的是( )
| A. | 反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解 | |
| B. | 溶液中(A2+)减小 | |
| C. | y电极上有H2产生,发生还原反应 | |
| D. | B的电极反应:B-2e═B2+ |
11.在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g)?R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( )
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在容器中共存 | ||
| C. | P、Q的反应速率相等内部 | D. | P、Q、R、S的浓度不再变化 |
18.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜的1万倍;N5可用作烈性炸药.下列说法不正确的是( )
| A. | 金刚石与碳纳米管互为同素异形体 | B. | N5与N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | 乙醇和二甲醚属于同分异构体 |
16.同温同压下,等体积的两个密闭容器中分别充满12C18O和14N2两种气体,下列说法正确的是( )
| A. | 分子数和质量分别不等 | B. | 质子数相等,质量不等 | ||
| C. | 分子数和质量都相等 | D. | 原子数、中子数和质子数都相等 |

 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1