题目内容
1. 某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处
某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处SO42-从右向左移动.下列分析正确的是( )
| A. | 反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解 | |
| B. | 溶液中(A2+)减小 | |
| C. | y电极上有H2产生,发生还原反应 | |
| D. | B的电极反应:B-2e═B2+ |
分析 该装置中右边装置不能自发的进行氧化还原反应是不能构成原电池只能形成电解池,左边装置中能发生的进行氧化还原反应且符合原电池的构成条件所以是原电池.当 K 闭合时,在交换膜处 SO42-从右向左移动,说明A为负极,B为正极,即A的金属活动性大于B;连接B的y极为Y阳极,连接A的x极为阴极.
解答 解:A、右边装置中y极上发生的电极反应式为2Cl--2e-=Cl2↑,x极上发生的电极反应式为2H++2e-=H2↑,由于氢离子放电而氢氧根离子不放电导致溶液呈碱性,铝离子和氢氧根离子反应生成难溶性的氢氧化铝,氢氧化铝和氢氧根离子反应生成可溶性的偏铝酸盐,故A正确;
B、当 K 闭合时,在交换膜处 SO42-从右向左移动,说明A为负极,B为正极,原电池中负极A上金属失电子发生氧化反应,生成金属阳离子进入溶液导致溶液中(A2+)浓度增大,故B错误;
C、右边装置中连接B的y极为阳极,连接A的x极为阴极,电解池工作时,y极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,故C错误;
D、当 K 闭合时,在交换膜处 SO42一从右向左移动,说明A为负极,B为正极,B极上溶液中的金属阳离子得电子生成金属单质,电极反应式为B2++2eˉ═B,故D错误.
故选:A.
点评 本题考查了原电池和电解池原理,难度较大,明确原电池放电时溶液中阴阳离子的移动方向是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.氯气和漂白粉是现代工业和生活中常用的消毒液、杀菌剂.
(1)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)实验室有一瓶密封不严的漂白粉样品,其中一定含有CaCl2、Ca(OH)2,请设计实验,探究该样品中可能存在的其它固体物质
①提出合理假设
假设1:该漂白粉未变质,含Ca(ClO)2
假设2:该漂白粉全部变质,含CaCO3
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)3
②设计实验方案,进行实验,并完成实验报告.
(1)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)实验室有一瓶密封不严的漂白粉样品,其中一定含有CaCl2、Ca(OH)2,请设计实验,探究该样品中可能存在的其它固体物质
①提出合理假设
假设1:该漂白粉未变质,含Ca(ClO)2
假设2:该漂白粉全部变质,含CaCO3
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)3
②设计实验方案,进行实验,并完成实验报告.
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
9.甲学生对Cl2和FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为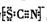 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
③若SCN-与Cl2反应生成1molCO2,则转移电子的物质的量是16mol.
| 操作 | 现象 |
通入氯气至过量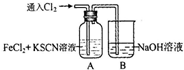 | Ⅰ、A中溶液变红 Ⅱ、稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
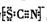 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
③若SCN-与Cl2反应生成1molCO2,则转移电子的物质的量是16mol.
16.下列每步转化不能通过一步反应就实现的是( )
| A. | N2→NO→NO2 | B. | Fe→FeCl2→Fe (OH)2 | C. | S→SO3→H2SO4 | D. | Na→Na2O2→NaOH |
6.下列说法中正确的是( )
| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
10.下列各组性质比较中,不正确的是( )
| A. | 元素最高化合价:Al>Mg | B. | 金属性:Al>Mg | ||
| C. | 酸性:H2SO4>H3PO4 | D. | 稳定性:HF>HCl |
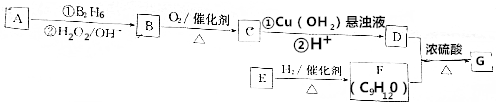
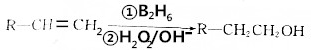
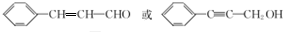 .
.