题目内容
1.下列是说法正确的是( )| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
分析 A.水分子间存在氢键,而不是分子中;
B.氢原子和氧原子之间以共用电子对而形成水分子;
C.碱金属随原子序数的增大,半径增大,金属键减弱;卤素单质随原子序数的增大,相对分子质量增大;
D.HF分子间有氢键,熔沸点较高.
解答 解:A.水分子间存在氢键,所以水的沸点较高,故A正确;
B.H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为 ,故B错误;
,故B错误;
C.碱金属随原子序数的增大,半径增大,金属键减弱,则熔沸点逐渐降低;卤素单质随原子序数的增大,相对分子质量增大,则熔沸点逐渐升高,故C错误;
D.HF分子间有氢键,熔沸点比HCl的高,故D错误.
故选:A.
点评 本题考查元素周期表和元素周期律,为高频考点,把握主族元素及同周期元素性质的变化规律为解答的关键,注意熔点比较、半径比较的方法,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
11.下列有关元素周期表说法正确的是( )
| A. | 第 IA族元素都是碱金属元素 | |
| B. | 元素原子的最外层电子数等于它的族序数 | |
| C. | 最外层电子数相同的元素不一定在同一个族 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
12.将10molA和5molB放入10L真空容器内,某温度下发生反应:3A(g)+B(g)?2C(g),在最初的2min内,消耗A 3.6mol,则在2min时,C的平均速率是( )
| A. | 0.12mol/(L•min) | B. | 0.18 mol/(L•min) | C. | 1.8 mol/(L•min) | D. | 1.2mol/(L•min) |
16.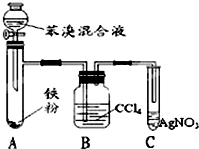 如表是A、B、C三种烃的有关信息;
如表是A、B、C三种烃的有关信息;
根据表中信息回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学反应方程式CH2=CH2+Br2→CH2BrCH2Br;写出在一定条件下,A生成加聚的化学反应方程式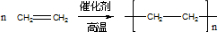 .
.
(2)B具有的性质是②③(填编号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
(3)实验室制取C化学反应方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(4)如图是B与液溴制取溴苯的装置,试回答:
(a)装置A中发生有机反应的化学方程式是 .
.
(b)装置C中的现象导管口有白雾出现,溶液出现淡黄色沉淀.
(c)装置B中的作用吸收挥发出来的溴.
 如表是A、B、C三种烃的有关信息;
如表是A、B、C三种烃的有关信息;| A | B | C |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  | 1棍模型为: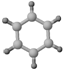 ②平面型结构 | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与H2在一定条件下反应生成A |
(1)写出A与溴的四氯化碳溶液反应的化学反应方程式CH2=CH2+Br2→CH2BrCH2Br;写出在一定条件下,A生成加聚的化学反应方程式
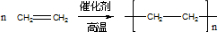 .
.(2)B具有的性质是②③(填编号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(3)实验室制取C化学反应方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(4)如图是B与液溴制取溴苯的装置,试回答:
(a)装置A中发生有机反应的化学方程式是
 .
.(b)装置C中的现象导管口有白雾出现,溶液出现淡黄色沉淀.
(c)装置B中的作用吸收挥发出来的溴.
6.KMnO4+HCl-KCl+MnCl2+H2O+Cl2,方程式配平后,HCl前的化学计量数为( )
| A. | 8 | B. | 12 | C. | 16 | D. | 20 |
13.下列有关化学用语的表述正确的是( )
| A. | CO2的比例模型: | |
| B. | N2H4的电子式为: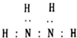 | |
| C. | NaH中氢离子结构示意图为: | |
| D. | 质子数是82,中子数是122的铅原子:${\;}_{82}^{122}$Pb |
10.相同条件下,1体积某气态烃只能与1体积氯气发生加成反应,生成氯代烷.此氯代烷0.5mol可与3mol氯气发生完全取代反应,则该烃的结构简式为( )
| A. | CH3CH3 | B. | CH2═CH2 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
11.下列有关物质的结构的说法正确的是( )
| A. | 3.4g氨气中含有0.6NA个N-H键 | |
| B. | 78g Na2O2晶体中所含阴阳离子个数均为4NA | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 |