题目内容
16. 如表是A、B、C三种烃的有关信息;
如表是A、B、C三种烃的有关信息;| A | B | C |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  | 1棍模型为: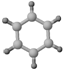 ②平面型结构 | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与H2在一定条件下反应生成A |
(1)写出A与溴的四氯化碳溶液反应的化学反应方程式CH2=CH2+Br2→CH2BrCH2Br;写出在一定条件下,A生成加聚的化学反应方程式
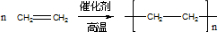 .
.(2)B具有的性质是②③(填编号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(3)实验室制取C化学反应方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
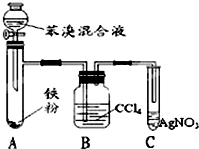
(4)如图是B与液溴制取溴苯的装置,试回答:
(a)装置A中发生有机反应的化学方程式是
 .
.(b)装置C中的现象导管口有白雾出现,溶液出现淡黄色沉淀.
(c)装置B中的作用吸收挥发出来的溴.
分析 由比例模型可知A为乙烯,B为苯,C为乙炔,
(1)乙烯通入溴的四氯化碳溶液中,乙烯与溴发生加成反应,含碳碳双键,发生加聚反应生成聚乙烯;
(2)B为苯,为无色有刺激性气味的液体、有毒、不溶于水、密度比水小、与酸性KMnO4溶液不反应、在一定条件下与氢气发生加成反应,苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应;
(3)实验室用碳化钙和水反应制备乙炔;
(4)苯与液溴在催化剂条件下发生取代反应生成溴苯和HBr,用四氯化碳除去溴,用硝酸银验证生成HBr,以此解答该题.
解答 解:由比例模型可知A为乙烯,B为苯,C为乙炔,
(1)乙烯通入溴的四氯化碳溶液中,乙烯与溴发生加成反应,该反应为:CH2=CH2+Br2→CH2BrCH2Br,含碳碳双键,发生加聚反应生成聚乙烯,该加聚反应为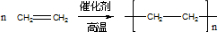 ,
,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;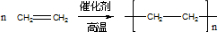 ;
;
(2)B为苯,为无色有刺激性气味的液体、有毒、不溶于水、密度比水小、与酸性KMnO4溶液不反应、在一定条件下与氢气发生加成反应,苯易发生取代反应,与浓硝酸、浓硫酸的混合酸共热时发生硝化反应,即
故答案为:②③;
(3)实验室用碳化钙和水反应制备乙炔,方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(4)①苯与液溴在铁做催化剂条件下发生取代反应化学方程式为: ;
;
故答案为: ;
;
②溴化氢与硝酸银反应生成浅黄色的溴化银和硝酸,且溴化银不溶于硝酸;C中生成了淡黄色沉淀,证明反应中生成了溴化氢,且导管口有白雾出现,
故答案为:导管口有白雾出现,溶液出现淡黄色沉淀;
③溴易挥发,易溶于四氯化碳,用四氯化碳吸收挥发出来的溴;
故答案为:吸收挥发出来的溴.
点评 本题综合考查有机物的结构、性质以及制备,侧重学生的分析能力和实验能力的考查,注意把握有机物的结构以及官能团的性质,把握实验的原理和操作方法,难度不大.

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 二氧化碳的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 四氯化碳的电子式: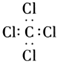 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查阅资料得到以下有关高氯酸的信息:
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

(1)操作①的名称是过滤.
(2)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的为了产物能得到HClO4而不是NaClO4.
(3)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(4)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4.
(5)若想得到201kg的 HClO4纯品,至少需要NaClO3639kg.
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)4H2O+HCl-8e-=HClO4+8H+.
| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
| A. | N2O和CO2 | B. | O3和NO2 | C. | CH4和NH3 | D. | OH-和NH2 |
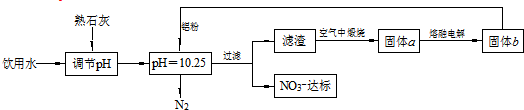
下列说法不正确的是( )
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无毒 | |
| D. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b |
 、加聚反应
、加聚反应 、加成反应
、加成反应 、取代反应.
、取代反应.