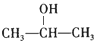
题目内容
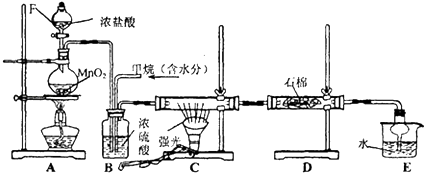
14.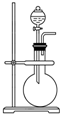 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.(1)该制气装置在加入反应物前,应事先进行的操作是检查装置气密性.
(2)若用该装置制取O2,反应物可选择过氧化氢与二氧化锰(或水与过氧化钠) (填试剂名称);
(3)若用该装置制取NO2,反应的化学方程式为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O.
(4)利用该装置还可制取abcd(选填下列字母序号)等气体.
a.H2 b.CO2 c.NH3 d.SO2.
分析 (1)该装置在加入反应物前,先检查装置气密性;
(2)该装置为固液不加热装置,可以用过氧化氢和二氧化锰,或水与过氧化钠反应制备氧气;
(3)用该装置制取NO2,利用Cu与浓硝酸反应制备;
(4)该装置为固液不加热装置,结合气体的制备原理分析.
解答 解:(1)该装置在加入反应物前,为了防止漏气,应首先检查装置气密性,故答案为:检查装置气密性;
(2)该装置为固液不加热装置,可以用二氧化锰催化过氧化氢分解生成氧气,或水与过氧化钠反应生成氢氧化钠和氧气,
故答案为:过氧化氢与二氧化锰(或水与过氧化钠);
(3)用该装置制取NO2,利用Cu与浓硝酸反应制备,反应为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(4)该装置为固液不加热装置,
a.用锌与稀硫酸反应制备H2 ,可以选用该装置,故a选;
b.用盐酸和石灰石制备CO2 ,可以选用该装置,故b选;
c.用生石灰与浓氨水制备NH3,可以选用该装置,故c选;
d.用稀硫酸与亚硫酸钠反应制备SO2,可以选用该装置,故d选;
故答案为:abcd.
点评 本题考查气体的制备实验,为高频考点,侧重于学生的分析能力、实验能力的考查,把握气体的制备反应原理、实验技能、实验装置的作用为解答的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.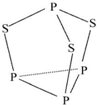 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )| A. | 该物质中磷元素的化合价为+3 | |
| B. | 该物质分子中不含非极性共价键 | |
| C. | 该物质的熔、沸点比P4低 | |
| D. | 该物质22 g含硫原子的数目约为1.806×1023 |
6.下列物质:①BeCl2 ②C2H4 ③P4 ④BF3 ⑤NF3 ⑥H2O2,其中含极性键的非极性分子是( )
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
4.某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料.由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.
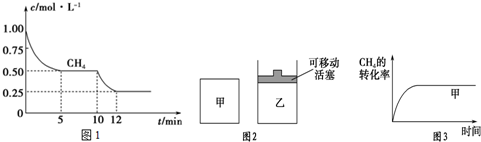
反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度.反应①平衡常数表达式为$\frac{c(CO)•c({H}_{2})^{3}}{c(C{H}_{4})•c({H}_{2}O)}$.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应③中△H3=-41.2kJ/mol.800℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见表:
此时反应③中正、逆反应速率的关系式是a(填代号).
a.v正>v逆 b.v正<v逆 c.v正=v逆 d.无法判断.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.

反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度.反应①平衡常数表达式为$\frac{c(CO)•c({H}_{2})^{3}}{c(C{H}_{4})•c({H}_{2}O)}$.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应③中△H3=-41.2kJ/mol.800℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v正>v逆 b.v正<v逆 c.v正=v逆 d.无法判断.
 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.

 +NaCl;
+NaCl;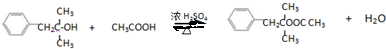 ;
;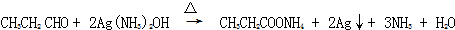 .
.
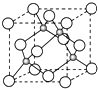 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: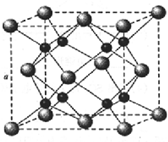 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题: