题目内容
4.镁带能在CO2中燃烧,生成氧化镁和单质碳.(1)碳元素形成的单质有金刚石、石墨、足球烯等.金刚石的熔点远高于足球烯的原因是金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力.24g金刚石中含有4NA个碳碳单键.
(2)氧化镁的电子式为Mg2+[
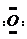 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.一定条件下,在容积恒为2.0L的容器中,Fe和CO2发生如下反应:
CO2(g)+Fe(s)?FeO(s)+CO(g)
(3)若起始时向容器中加入1mol CO2,5.0min后,容器内气体的相对平均分子量为32,则这段时间内ν(CO2)=0.025mol/(L•min).
(4)下列说法不正确的是cd
a.当混合气体的密度不变时说明反应达到了平衡
b.混合气体的平均相对分子质量不变时说明反应达到了平衡
c.平衡后移除二氧化碳时,正反应速率一直减小直至建立新的平衡
d.平衡后缩小容器的体积,正逆反应速率不变,平衡不移动
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动(选填“正向”、“逆向”、或“不”),二氧化碳的转化率不变(填“增大”,“减小”或“不变”),CO的物质的量增大(选填“增大”,“减小”或“不变”).
分析 (1)原子晶的沸点高于分子晶体;24g金刚石物质的量为2mol,每1mol碳原子和4mol碳原子形成共价键,则1mol碳原子形成的共价键为:1mol×4×$\frac{1}{2}$=2mol,所以2mol金刚石含有碳碳键的个数为4NA;
(2)氧化镁的电子式为Mg2+[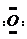
(3)若起始时向容器中加入1mol CO2,5.0min后,容器内气体的相对平均分子量为32,说明变化的氧原子质量为8g,变化的二氧化碳的物质的量为0.25mol,根据速率的计算公式计算;
(4)当变量不变时平衡,根据平衡移动的影响因素分析;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变,CO的物质的量增大.
解答 解:(1)金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力,故熔点金刚石大于石墨烯;24g金刚石物质的量为2mol,每1mol碳原子和4mol碳原子形成共价键,则1mol碳原子形成的共价键为:1mol×4×$\frac{1}{2}$=2mol,所以2mol金刚石含有碳碳键的个数为4NA,故答案为:金刚石为原子晶体而足球烯为分子晶体,金刚石中共价键的键能高于足球烯中的范德华力;4NA;
(2)氧化镁的电子式为Mg2+[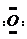
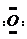
(3)若起始时向容器中加入1mol CO2,5.0min后,容器内气体的相对平均分子量为32,说明变化的氧原子质量为8g,变化的二氧化碳的物质的量为0.25mol,根据速率的计算公式知,ν(CO2)=$\frac{\frac{0.25}{2}}{5}$=0.025mol/(L•min);
(4)一定条件下,在容积恒为2.0L的容器中,CO2(g)+Fe(s)?FeO(s)+CO(g),
a.当混合气体的密度是变量,不变时说明反应达到了平衡,故正确;
b.混合气体的平均相对分子质量是变量,不变时说明反应达到了平衡,故正确;
c.平衡后移除二氧化碳时,正反应速率先减小后增大,直至建立新的平衡,故错误;
d.平衡后缩小容器的体积,正逆反应速率增大,但平衡不移动,故错误;
故答案为:cd;
(5)待反应达到平衡后再充入一定量的二氧化碳,平衡向正向移动,但到达新平衡时的效果与原平衡等效,故二氧化碳的转化率不变,CO的物质的量增大,故答案为:正向;不变;增大.
点评 本题考查了电子式、结构式、熔沸点高低比较、化学反应速率、化学平衡等知识,属于综合性题型,解题时要细心,避免书写的错误,难度中等.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| C. | 氢气之所以被称为“绿色能源”是因为它燃烧的产物不会污染环境 | |
| D. | 人类利用的能源都是通过化学反应获得的 |
| A. | 3.0g乙酸与甲酸甲酯的混合物中含有氧原子数目为0.2NA | |
| B. | 苯与液溴反应生成1mol溴苯分子,消耗0.5NA个Br2 | |
| C. | 常温常压下,等质量的N2H4和CH3OH含有相同数目的原子 | |
| D. | 6gSiO2晶体中含有0.4NA个Si-O键 |
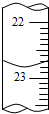 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是托盘天平和250mL容量瓶.
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②酸化KMnO4溶液的酸应为稀硫酸.(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:□MnO→+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏低的是C.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
 ①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.
①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.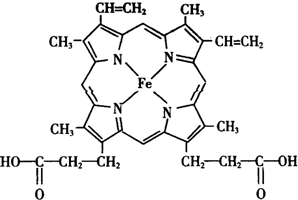 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.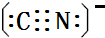 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式). 请回答下列问题:
请回答下列问题: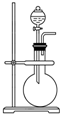 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.